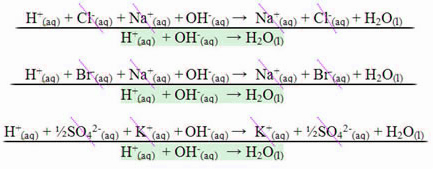Elektroliz kendiliğinden olmayan, yani doğal olarak meydana gelmeyen, suda erimiş veya çözünmüş bileşiklerde elektriksel boşalma yoluyla maddelerin oluşturulduğu bir süreçtir. Bu işlemde, bir elektrik akımı, iki inert elektrotu olan (acı çekmeyen veya etkilenmeyen) bir cam kaba (elektrolitik tank) ulaşır. oksidasyon ne de azalma) grafit veya platin tarafından oluşturulur. Bu elektrotlar bir elektrik kaynağına (genellikle bir davul) ve erimiş veya suda çözülmüş bir tuz veya baza daldırılır. Tıpkı pil, elektrolizin bir katodu (indirgemenin gerçekleştiği yer) ve bir anot (oksidasyonun gerçekleştiği yer) vardır.
Özet
Elektroliz, kendiliğinden olmayan bir süreçtir;
Basit veya kompozit maddeler oluşturulabilir;
Erimiş bir çözünen (magmatik elektroliz) ile oluşabilir;
Suda çözünmüş bir çözünen (sulu elektroliz) ile oluşabilir;
Bir katyon her zaman katotta indirgenmeye uğrar;
Bir anyon her zaman anotta oksidasyona uğrar.
Ayrıca bakınız:Elektrolizden alüminyum elde etmek

Elektroliz türleri
Erimiş bir iyonik bileşik üzerinde bir elektrik boşalması gerçekleştirildiğinde meydana gelen bir elektrolizdir. İyonik bileşik, örneğin bir iyonik bağ tarafından oluşturulan bir bileşiktir. tuz veya bir baz inorganik. Erimiş bileşik hakkında konuştuğumuzda, katı halden sıvı hale geçen bileşiğe atıfta bulunuruz.
- Magmatik elektroliz örneği
Potasyum klorürün (KCl) füzyonunu yaptığımızda, bu tuz ayrışma sürecine girerek potasyum katyonunu (K) serbest bırakır.+) ve iyodür anyonu (l-).

Potasyum klorür için ayrışma denklemi
Elektrik akımı bu iyonlarla elektrolitik hücreye ulaştığında, potasyum katyonu indirgenerek metalik potasyum (K) oluşturur ve iyodür anyonu oksitlenerek katı iyot (I) oluşturur.2).
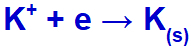
Katı potasyum oluşum denklemi
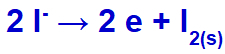
Katı iyot oluşumu denklemi
Bir tuz veya inorganik bazın oluşturduğu sulu bir çözelti (su içeren) üzerinde elektrik boşalması gerçekleştirildiğinde meydana gelen bir elektrolizdir.
- Sulu elektroliz örneği
Sodyum klorürü suda çözdüğümüzde ayrışır ve su iyonizasyona uğrar:

Su İyonizasyonu ve Sodyum Klorür Ayrışma Denklemleri
Sodyum katyonu olarak (Na+) IA ailesine aittir, hidronyum katyonu (H+) deşarjdan geçer ve indirgenerek hidrojen gazı oluşturur (H2).
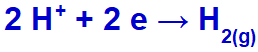
Hidrojen gazı oluşum denklemi
klorür olarak (Cl-) oksijenli değildir (oksijeni yoktur) ve florür değildir (F-), deşarj olur, oksitlenir ve klor gazı oluşturur (Cl2).

Klor gazı oluşum denklemi
seçici iyon deşarjı
Sulu bir ortamda (su ve bir çözünenden oluşan çözelti) elektroliz işlemi sırasında, her zaman iki katyona sahip olacağız: sudan hidronyum ve sudan herhangi bir başka katyon. tuz ayrışması (çözünen bir örneği). Ayrıca iki anyonumuz olacak: sudan gelen hidroksil ve tuzdan gelen bir tane daha.

Su iyonizasyonundan ve tuz ayrışmasından kaynaklanan iyonlar
- Katyonlar ve anyonlar için seçici deşarj
Çözünen maddeden gelen katyon IA, IIA veya IIIA ailesine aitse, hidronyum (H+) Azaltılacak;
Çözünen maddeden gelen katyon yukarıda bahsedilen ailelere ait değilse indirgenmeye maruz kalacaktır.
Çözünen maddenin anyonunun bileşiminde oksijen varsa veya bir florürse (F-), hidroksit (OH-) oksidasyona uğrayacaktır;
-
Eğer çözünenden gelen anyon yukarıdaki özelliklere sahip değilse oksidasyona uğrayacaktır.
Şimdi durma... Reklamdan sonra devamı var ;)
Suyun hidronyum iyonları (H) üreterek kendi kendine iyonlaşma yeteneğine sahip olduğu bilinmektedir.+) ve hidroksit (OH-), ancak bu iyonlaşma oldukça sınırlıdır. Bu gerçek, elektrik akımını iletmede saf suyun verimsizliği ile kanıtlanmıştır.
Gibi elektroliz elektrik deşarjını içerir, suyun elektrolizini gerçekleştirmek için bir çözünen maddenin çözülmesi gerekir, hidronyum ve hidroksitin seçici deşarjını destekleyen (deşarj konusunda görüldüğü gibi) seçici).
Sodyum sülfat eklersek (Na2SADECE4), örneğin, ortada sodyum katyonları olacak (Na+) ve hidronyum (H+), yanı sıra hidroksit anyonları (OH-) ve sülfat (SO4-2). Böylece, elektrolitik tanka elektrik akımı geldiğinde:
sodyum IA ailesine ait olduğu için hidronyum indirgeyerek boşaltılacaktır;
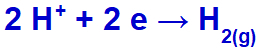
Hidrojen gazı oluşum denklemi
hidroksit, sülfatın bileşiminde oksijene sahip olduğu için oksitlenerek deşarja uğrayacaktır.
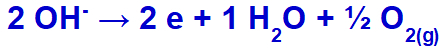
Oksijen gazı oluşum denklemi
Sudan gelen iki iyon (katyon ve anyon) boşalırken suyun elektrolizinin gerçekleştiğini söylüyoruz.
Ayrıca bakınız: Elektrolizin nicel yönleri
Hidrojen gazı gibi basit maddelerin üretimi (H2), oksijen gazı (O2) vb.;
Sodyum hidroksit (NaOH), sülfürik asit (H) gibi kompozit maddelerin üretimi2SADECE4) vb;
Bir parçanın bakır (bakır) ve altın (altın kaplama) gibi belirli bir metalle kaplanması;
Cevherinizden belirli bir metali çıkarmak için kullanın.
Elektroliz Üzerine Çözülmüş Alıştırmalar
Örnek 1 - (Vunesp) Sulu bir CuCℓ çözeltisi2 platin elektrotlar kullanılarak elektrolize tabi tutulur. Doğru ifade şudur:
a) Katotta Cu iyon indirgemesi meydana gelir2+.
b) Anotta Cu iyon oksidasyonu meydana gelir2+.
c) Katotta klor gazı oluşur.
d) Platin anotun bir kısmı çözünür ve Pt oluşturur.2+.
e) CuCl'nin elektrolizi olsaydı, bu elektrolizin ürünleri farklı olurdu.2 ateşliydi (füzyon).
a) Doğru. Ne zaman CuCl2 suda çözülür, hidronyum katyonlarına sahibiz (H+) ve bakır II (Cu+2). Bakır II katyonu IA, IIA ve IIIA ailelerine ait olmadığı için indirgenir.
b) Yanlış, klorür anyonu (Cl) anotta oksitlendiğinden-), bileşiminde oksijen bulunmayan ve florür olmayan (F-).
c) Yanlış, bakır II katyonunun indirgenmesi katotta meydana geldiğinden, bakır metali oluşur.
d) Yanlış, elektrolizde platin veya grafit elektrotlar sadece elektriği ilettikleri için sürece katılmazlar.
e) Yanlış, bakır klorür II'nin (CuCl) magmatik elektrolizi olarak2) mevcut iyonlar bakır II (Cu) olacağından, sulu olanla tamamen aynı ürünleri sunacaktır.+2) ve klorür (Cl-1).
Örnek 2- (UFRN) Aşağıdaki sistemleri göz önünde bulundurun:
BEN. Erimiş sodyum klorür;
II. Sodyum klorür sulu çözeltisi;
III. Kaynaşmış sodyum hidroksit;
IV. Sodyum hidroksit sulu çözeltisi.
Elektrolize tabi tutulduğunda sodyum sağlayabilenler şunlardır:
a) sadece I ve II.
b) sadece I ve III.
c) sadece II ve IV.
d) sadece III ve IV.
e) I, II, III ve IV.
Katotta ürün olarak metalik sodyum sağlayan sistemler I ve III'tür.
I- Ortamda bulunan tek katyon sodyum katyonudur, bu nedenle sadece metalik sodyum oluşturarak indirgenebilir.
II- Bu sistem sağlamaz metalik sodyum, çünkü sodyum klorür suda çözülmüştür, bu nedenle ortada sodyum katyonlarının varlığına sahibiz (Na+) ve hidronyum (H+) - sodyum IA ailesine ait olduğu için azalmadan muzdarip olan budur.
III- Ortamda bulunan tek katyon sodyum katyonudur (çünkü malzeme füzyona tabi tutulmuştur), bu nedenle sadece indirgenerek metalik sodyum oluşturur;
IV- Bu sistem sağlamaz metalik sodyum, çünkü sodyum hidroksit suda çözülmüştür, bu nedenle ortada sodyum katyonlarının varlığına sahibiz (Na+) ve hidronyum (H+) - sodyum IA ailesine ait olduğu için azalmadan muzdarip olan budur.
Benden Diogo Lopes Dias