Molekylernas polaritet är en mycket viktig aspekt, eftersom egenskaperna hos ämnen bestäms bland annat av det faktum att deras molekyler är polära eller icke-polära.
Bestämningen av polariteten hos en molekyl kan utföras med hjälp av Dipole Moment eller Resulterande Dipole Moment, vars symbol är 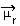 . Om vi bara pratar om dipolmomentet för varje bindning i molekylen, är symbolen den grekiska bokstaven mi (µ).
. Om vi bara pratar om dipolmomentet för varje bindning i molekylen, är symbolen den grekiska bokstaven mi (µ).

Molekylen kommer att vara opolär om dipolmomentet är lika med noll, men om det inte är noll betyder det att det är polärt.

Det finns två viktiga saker att tänka på för att bestämma detta resulterande dipolmoment. Låt oss se vad de är:
1) elektronegativitetsskillnad mellan atomerna hos de element som deltar i reaktionen. Till exempel har HF-molekylen en markant skillnad i elektronegativitet, eftersom fluor lockar mycket mer än väte till elektronparet i bindningen. Således är laddningsfördelningen inte symmetrisk med elektriska dipoler.
Denna dipol representeras av en vektor som vetter mot änden som koncentrerar flest elektroner, det vill säga från den minst till den mest elektronegativa atomen. Så i det här fallet kommer vektorn, som är den enda, att bli den resulterande vektorn, som anges nedan:
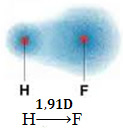
Observera att vektorvärdet är detsamma som dipolmomentet, vilket ges i avskiljningsenhet (D = 3,33. 10-30 coulomb. tunnelbana). Eftersom dipolmomentet inte är noll är molekylen och bindningen polär.
Sluta inte nu... Det finns mer efter reklam;)
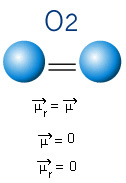
I molekylen nedan har vi också en molekyl med bara två atomer, men i det här fallet motsvarar den en enkel substans, det vill säga den består av endast en typ av element. Därför finns det ingen skillnad i elektronegativitet; atomer lockar också elektroner, som är symmetriskt fördelade. Det resulterande dipolmomentet är lika med noll, så både bindningen och molekylen är apolar.
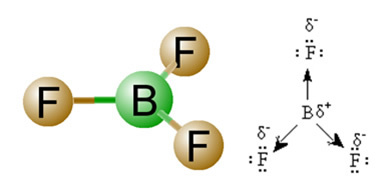
2) Molekylgeometri, det vill säga det rumsliga arrangemanget av vektorerna. BF-molekylen3 den har tre polära bindningar, i vilka fluor är den mest elektronegativa, och därmed har vektorerna riktade mot den. Eftersom emellertid det rumsliga arrangemanget av atomerna är platt trigonal, får detta elektronerna en symmetrisk fördelning runt den centrala atomen. Resultatet är således att dessa tre vektorer avlägsnar varandra och dipolmomentet är lika med noll. Därför BF-molekylen3 é ber om ursäkt.
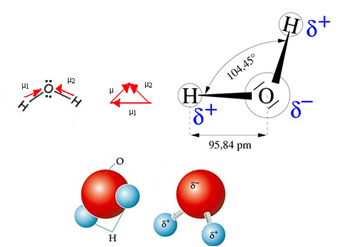
Vattenmolekylen har två vektorer, men dess rumsliga geometri är inte platt utan i form av en V. Observera i följande figur att detta sätt att deras vektorer inte avbryter varandra, elektronerna fördelas asymmetriskt och mer koncentrerade i den mest elektronegativa atomen, som är syre. Således skiljer sig dipolmomentet från noll och vattenmolekylen är det polär:
Av Jennifer Fogaça
Examen i kemi