När vi lagar mat hemma använder vi gasförbränning. En av de saker som vi kan se i lågan till följd av förbränningen av denna gas är att dess färg normalt är mycket ljusblå. Men i de flesta förbränningsreaktioner, som att tända ett ljus, är flamman gul.

Då uppstår frågan:
"Om varje brand är resultatet av en förbränningsreaktion, varför har vissa lågor olika färger?"
För att förstå hur detta händer måste vi förstå vad en förbränningsreaktion är och vilka ämnen som finns i var och en av de nämnda reaktionerna.
En förbränningsreaktion inträffar när ett bränsle (oxiderbart material) förbrukas av ett oxidationsmedel (ett gasformigt material som innehåller syre) för att generera termisk energi (värme).
En annan viktig punkt som vi behöver veta om förbränningsreaktioner är att de kan förekomma i en fullständig eller ofullständig. Om det finns tillräckligt med syre för att konsumera bränslet kommer reaktionen att vara fullständig och producera koldioxid (CO2) och vatten (H2O). Annars kommer förbränningen att vara partiell, ofullständig och alstra kolmonoxid (CO) och vatten; eller kol (C) och vatten.
I båda fallen analyserar vi att oxidatorn är det syre som finns i luften. Men bränslen är olika. Matlagningsgas är faktiskt flytande petroleumgas (LPG), som är en blandning av kolväten (alkaner), varvid huvudbränslet är butan (C4H10). Således består kokgas av alkanmolekyler som bara har tre eller fyra kolatomer, det är därför lite syre behövs för att förbränningen ska kunna ske helt. Denna reaktion kan uttryckas enligt följande:
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 timmar2O(g), ∆H <0
Sluta inte nu... Det finns mer efter reklam;)
När det gäller ljus är paraffinet bränslet för reaktionen och det består av en blandning av alkaner med kolatomer som från 20 till 36. Därigenom, det tar mycket mer syre för att denna reaktion ska kunna inträffa helt. Se ett exempel:
1C24H50 (s) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2O(g), ∆H <0
I luften finns det inte tillräckligt med syre för att utföra denna fullständiga förbränning, så det sker ofullständigt, som visas nedan:
1C24H50 (s) +49/2 O2 (g) → 24 CO(g) + 25 H2O(g), ∆H <0
1C24H50 (s) +25/2 O2 (g) → 24C(s) + 25 H2O(g), ∆H <0
Ofullständiga reaktioner ger mindre energi än fullständig förbränning. Detta förklarar skillnaden mellan flammornas färger, eftersom den gula lågan, som är karakteristisk för ofullständig förbränning, har lägre energi. Den blå lågan är karakteristisk för en fullständig förbränning med större energi.
Detta förklarar också sotets bildning av ljusflamman (bilden nedan), vilket är kol som anses vara en produkt av ofullständig förbränning.
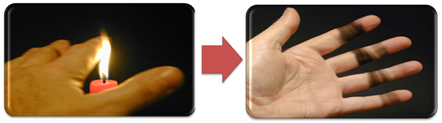
Men varför, i Bunsen-brännaren, är det möjligt att få gula och blåa lågor när bränslet inte ändras?
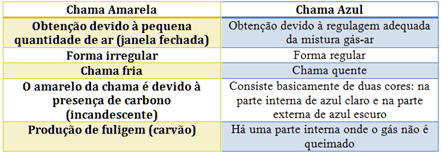
För Bunsen-brännaren uppnås detta genom att reglera inloppet av gas och luft. Om fönstret är stängt och orsakar inträde av en liten mängd luft blir den erhållna lågan gul eftersom den har lite syre för att utföra fullständig förbränning. Om regleringen av gas-luftblandningen är tillräcklig får vi en blå låga.
Se egenskaperna för var och en i tabellen nedan:
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Förbränning och lågor i olika färger"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm. Åtkomst den 28 juni 2021.