Det finns en gren av vetenskapen som studerar hastigheten för kemiska reaktioner och de faktorer som påverkar den, den kallas kemisk kinetik. Kemiska reaktioner kan definieras som en uppsättning fenomen där två eller flera ämnen reagerar med varandra, vilket ger upphov till olika föreningar. En kemisk ekvation är en grafisk representation av en kemisk reaktion, där reaktanter förekommer i den första delen och produkter i den andra.
A + B.  C + D
C + D
Reagensprodukter
Kunskapen och studien av reaktioner, förutom att vara mycket viktig i industriella termer, är också relaterad till vårt dagliga liv.
Reaktionens hastighet är hur snabbt reaktanter konsumeras eller hur snabbt produkter bildas. Att bränna ett ljus och bilda rost är exempel på långsamma reaktioner. I dynamit är nedbrytningen av nitroglycerin en snabb reaktion.
Hastigheterna för kemiska reaktioner bestäms genom empiriska lagar, kallade lagar av hastighet, härledd från effekten av koncentrationen av reaktanter och produkter på hastigheten av reaktion.
Kemiska reaktioner uppträder vid olika hastigheter och dessa kan ändras, förutom koncentration av reaktanter och produkter, beror reaktionshastigheter också på andra faktorer tycka om:
Reagenskoncentration: ju högre koncentrationen av reaktanterna desto snabbare blir reaktionen. För att en reaktion ska äga rum mellan två eller flera ämnen är det nödvändigt att molekylerna kolliderar så att det blir ett brott i bindningarna med den därav följande bildningen. Antalet kollisioner beror på koncentrationerna av A och B. Se bilden:
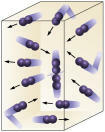
Molekyler kolliderar oftare om
vi ökar antalet reagerande molekyler.
Det är lätt att se att på grund av en högre koncentration kommer det att öka kollisionerna mellan molekyler.
anliggningsyta: en ökning av kontaktytan ökar reaktionshastigheten. Ett exempel är när vi löser upp en krossad sonrisaltablett och den löser sig snabbare än om det var helt, händer detta för att vi ökar kontaktytan som reagerar med Vatten.
Tryck: när du ökar trycket i ett gasformigt system ökar reaktionshastigheten.
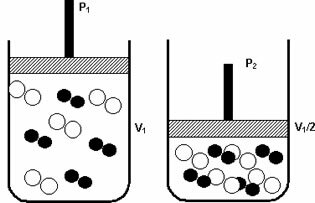
En ökning av trycket från P1 till P2 minskade volymen från VI till VI / 2, vilket påskyndade reaktionen på grund av att molekylerna närmade sig.
Figuren ovan exemplifierar, eftersom volymminskningen i den andra behållaren kommer att öka tryck som intensifierar molekylernas kollisioner och som en följd av en ökning av hastigheten på molekylerna reaktion.
Temperatur: när temperaturen i ett system höjs, sker det också en ökning av reaktionshastigheten. Att öka temperaturen innebär att molekylernas kinetiska energi ökar. I vardagen kan vi observera denna faktor när vi lagar mat och vi ökar spisens låga så att maten når graden av tillagning snabbare.
Katalysatorer: Katalysatorer är ämnen som påskyndar mekanismen utan att genomgå permanent förändring, det vill säga under reaktionen de inte konsumeras. Katalysatorer låter reaktionen ta en alternativ väg, vilket kräver mindre aktiveringsenergi, vilket får reaktionen att fortgå snabbare. Det är viktigt att komma ihåg att en katalysator påskyndar reaktionen, men inte ökar utbytet, det vill säga att den producerar samma mängd produkt, men på kortare tid.
Av Líria Alves
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm
