En av de stora utmaningarna för dem som lär sig kemi kallas elektronisk distribution. Vad vi kommer att presentera i detta sammanhang kan underlätta dina studier relaterade till den elektronkonfiguration som forskaren Linus Pauling föreslår.
Det maximala antalet elektroner som passar i varje lager eller energinivå ges genom tabellen:
Energinivåskikt Maximalt antal elektroner
1: a K 2
2: a L 8
3: e M 18
4: e N 32
5 ° O 32
6: e P 18
7: e F 8
Den ökande energiorden för undernivåerna är ordningen i diagonalernas ordning. Linus Pauling-diagrammet visas nedan:
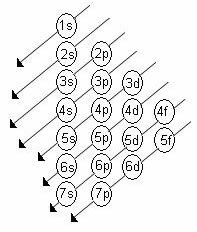
Grundläggande regler:
1. Elementets atomnummer (Z), i neutralt tillstånd, anger antalet elektroner som ska distribueras. Detta nummer visas i den nedre vänstra delen av elementets symbol.
2. Använd Pauling-diagrammet och börja distribuera elektronerna uppifrån och ner, med hänsyn till den ökande ordningen av energi (orienterad av pilarnas riktning).
3. Fyll undernivåerna med den maximala nivån av elektroner. Om ett givet undernivå bara rymmer 6 elektroner, överskrid inte den mängden.
4. Kontrollera antalet elektroner genom att lägga till dem i varje delnivå.
Låt oss omsätta det i praktiken?
Fördela elektronerna i järnatomen (Z = 26).
Om atomnumret är 26 betyder det att det i den normala järnatomen finns 26 elektroner. Genom att använda Pauling-diagrammet kommer vi att ha:

Av Líria Alves
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm


