Gasidealisk är den där kollisioner mellan partiklarna är helt elastiska. Mellan hans partiklar finns det ingen form av interaktion, som krafter attraktiv eller motbjudande, dessutom tar dessa partiklar inte plats.
Enligt kinetisk teori om gaser, beskrivs det termodynamiska tillståndet för en idealgas fullständigt av variablerna i tryck, volym och temperatur.
Seockså: Kalorimetri: tankekarta, formler och lösta övningar
idealiskt gaskoncept
Ideala gaser består uteslutande av partiklarimåttpunktlig (av försumbar storlek) som finns i rörelsekaotisk är på höghastighet. I denna typ av gas är temperaturen och hastigheten för partiklarnas translation proportionell.
Eftersom det inte finns någon interaktion mellan partiklarna i en idealgas, inre energi av denna gas är alltid lika med summan av gasen rörelseenergi av alla partiklar som utgör den.
Oavsett de ideala gaserna är kommer de alltid att ha samma siffraipartiklar för samma volym. Deras massa beror i sin tur direkt på din
molär massa (mätt i g / mol), dessutom, 1 mol idealgas (ca 6.0.1023 partiklar) kommer alltid att uppta a volym lika med 22,4 l.Du gaserverklig, där det förekommer kollisioneroelastisk mellan partiklar, kommer mycket nära beteendet hos ideala gaser i lågtrycks- och högtemperaturregimer. Tillfälligt, under normala förhållanden av tryck och temperatur på jorden (25 ° C och 1 atm), de flesta av gaser beter sig som ideala gaser, och detta underlättar beräkningen av förutsägelser om termodynamiskt beteende deras.
Vissa gaser, som vattenånga, som späds i atmosfärisk gas, kan inte betraktas som ideala gaser men ja gaserverklig. Dessa gaser har betydande interaktioner mellan deras partiklar, vilket kan kondensera, orsakar dem smälta, om det finns en temperaturfall.
Egenskaper för ideala gaser
Kolla in det på abstrakt, några egenskaper hos ideala gaser:
- I dem förekommer endast perfekt elastiska kollisioner mellan partiklar;
- I dem finns det inga interaktioner mellan partiklar;
- I dem har partiklarna försumbara dimensioner;
- 1 mol idealgas upptar en volym på 22,4 l, oavsett vad gasen är;
- Verkliga gaser beter sig som ideala gaser när de är under lågt tryck och höga temperaturer.
- De flesta gaser beter sig på samma sätt som ideala gaser.
ideal gaslag
Studien av gaser utvecklade av forskare Charlesboyle,JosephLouisgay-lussac och Robertboyle ledde till framväxten av tre empiriska lagar, används för att förklara beteendet hos idealgaser i regimer av temperatur, tryck och volymkonstanter, respektive.
Tillsammans bildade dessa lagar den nödvändiga grunden för framväxten av ideal gaslag, som relaterar till inledande termodynamiska tillstånd för en gas, definierad av kvantiteterna P1, T1 och V1, Med din slutligt termodynamiskt tillstånd (S2, V2 och t2), efter att ha lidit lite gasomvandling.
Kolla in formel av den allmänna gaslagen:
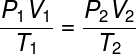
I den allmänna gaslagen anges att produkt ger tryck päls volymavgas, dividerat med den termodynamiska temperaturen, i kelvin, är lika med en konstant. Denna konstant beskrivs i sin tur av clapeyron ekvation, Kolla på:
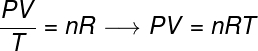
Nej - antal mol (mol)
R - universalkonstant av perfekta gaser (0,082 atm.l / mol. K eller 8,31 J / mol. K)
I formeln, P är trycket som utövas av gasen, V är den volym som upptas av denna gas, och T är temperaturen, mätt i kelvin. storheten Nej avser antalet mol, medan R är den universella konstanten av idealgaser, som ofta mäts i enheter av atm.l / mol. K eller i J / mol. K, den senare antas av SI.
Seockså:Vad är solvind och hur påverkar den jordens atmosfär?
Intern energi av idealgas
DE energiinre av ideala gaser kan beräknas med hjälp av produkten mellan konstantiBoltzmann och den termodynamiska temperaturen, notera:
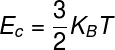
KB - Boltzmann konstant (KB = 1,38.10-23 J / K)
Från det tidigare förhållandet, vilket gör att vi kan beräkna genomsnittlig kinetisk energi från partiklarna av en idealgas drar vi följande formel, som kan användas för att beräkna vad genomsnittlig kvadrathastighet för molekyler av en idealgas, för en given temperatur T, notera:
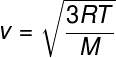
M - molär massa (g / mol)
Denna formel låter dig se att a tilläggpåtemperatur av en idealisk gas resulterar i en ökning av partiklarnas genomsnittliga kvadrathastighet.
Veta mer:Ta reda på vad ljus är gjort av och vilka egenskaper det har
Lösta övningar på ideala gaser
Fråga 1) Två mol idealgas och vid ett tryck på 1 atm finns vid en temperatur av 227 ° C. Beräkna, i liter, volymen som upptas av denna gas.
Data: R = 0,082 atm.l / mol. K
a) 75 l
b) 82 l
c) 15 l
d) 27 l
e) 25 l
Mall: Bokstaven B
Upplösning:
För att beräkna volymen på denna gas kommer vi att använda Clapeyron-ekvationen, men innan vi gör beräkningen är det nödvändigt att omvandla temperaturen på 227 ° C till en kelvin. För detta lägger vi till faktorn 273 till denna temperatur, vilket resulterar i en temperatur på 500 K.
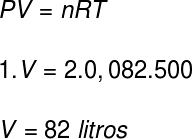
Enligt upplösningen är gasvolymen 82 liter.
Fråga 2) En idealgas upptar en volym på 20 liter när den utsätts för ett tryck på 3 atm så att dess temperatur förblir konstant medan volymen tredubblas. Beräkna det slutliga trycket för denna gas efter att den har gått igenom denna omvandling.
a) 1 bankomat
b) 3 atm
c) 5 atm
d) 8 atm
e) 9 atm
Mall: Bokstaven A
Upplösning:
För att lösa denna övning kommer vi att använda den allmänna gaslagstiftningen, notera:
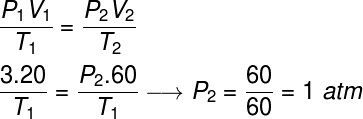
För att göra beräkningen var det nödvändigt att tilldela en volym på 60 liter till gasen, eftersom dess volym tredubblades under omvandlingen.
Av Rafael Hellerbrock
Fysiklärare

