DE oxidation och den minskning är reaktioner som uppstår när det finns en elektronöverföring mellan kemiska arter. De är motsatta reaktioner: i en oxidation sker en förlust av elektroner och i en reduktion finns en vinst av elektroner.
Dessa processer sker samtidigt, för när ett ämne donerar elektroner till ett annat oxideras det, medan ämnet som tar emot elektroner genomgår reduktion.
När ett ämne oxiderar gör det att de andra arterna minskar, därav namnet på ett reduktionsmedel. På samma sätt minskar ett ämne på grund av oxidation av ett annat och är därför oxidationsmedlet.
Oxidations- och reduktionsreaktionerna demonstreras av variationen av oxidationstalet (nox) för de inblandade arterna.
I allmänhet kan en reaktion som presenterar oxidation och reduktion representeras av:
A + B+ → A+ + B
Var,
A: ämne som oxideras, förlorar elektroner, ökar sitt värde och är reduktionsmedlet.
B: ämne som genomgår reduktion, får elektroner, minskar oxidation och är oxidationsmedlet.
Exempel på oxidation och reduktion
Se följande bild för ett exempel på den kemiska redoxekvationen.
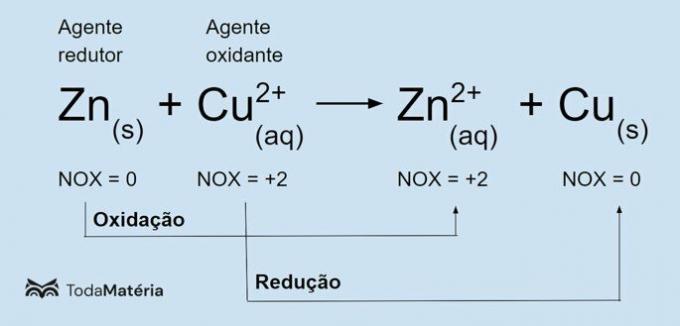
Den metalliska zinken genomgår oxidation och orsakar reduktionen av koppar, så det är reduktionsmedlet. Dess oxidationstal (nox) ökar från 0 till +2 eftersom den förlorar 2 elektroner.
Kuprijonen (Cu2+) genomgår reduktion och får koppar att oxidera, så det är oxidationsmedlet. Dess oxidationstal (nox) minskar från +2 till 0 eftersom den får 2 elektroner och blir metallisk koppar, som är elektriskt neutral.
Andra exempel på redoxreaktioner i vardagen är:
metanförbränning
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosyntes
6CO2(g) + 6H2O(v) → C6H12O6 (här) + 6O2(g)
järnkorrosion
2 Fe(s) + 3/4O2(g) + 3 timmar2O(v) → 2Fe (OH)3(s) (rost Fe2O3.3H2O)
Lära sig mer om oxidationstal (nox).
Hur uppstår oxidations- och reduktionsreaktioner?
Ekvationen för redoxreaktionen som involverar koppar och zink kan representeras av halvreaktioner, som visas nedan.
- oxidationshalvreaktion: Zn0(s) → 2e- + Zn2+(här)
- Reduktion halvreaktion: ass2+(här) + 2e- → ass0(s)
- global ekvation: Zn0(s) + asså2+(här) → Zn2+(här) + asså0(s)
Denna elektronöverföring i redoxreaktionen sker enligt reduktionspotentialen hos de inblandade arterna. Komponenten med lägst reduktionspotential har en tendens att donera elektroner, medan den med högst potential kommer att ta emot dem.
Till exempel har zink en reduktionspotential på -0,76V, medan koppar har en reduktionspotential på +0,34V. Därför är zink, eftersom det har en lägre reduktionspotential, ett bättre reduktionsmedel och främjar reduktionen koppar, som har en högre reduktionspotential och därför får elektroner och orsakar zinkoxidation.
Läs även om redoxreaktioner.
Övningar om oxidation och reduktion
Använd följande frågor för att testa dina kunskaper om vad du har lärt dig i den här texten.
fråga 1
Angående oxidations- och reduktionsreaktioner är det korrekt att konstatera det
a) Ökningen av nox för den kemiska arten indikerar att den har genomgått en minskning.
b) Ämnet som förlorar elektroner genomgår oxidation och är ett oxidationsmedel.
c) Vid redoxreaktioner överförs elektroner.
d) Ämnet som tar upp elektroner reduceras och är ett reduktionsmedel.
e) Minskningen av nox för den kemiska arten indikerar att den har genomgått oxidation.
Rätt alternativ: c) I oxidations-reduktionsreaktioner sker elektronöverföring.
Vid redoxreaktioner överförs elektroner.
Ämnet som får elektroner genomgår reduktion och är oxidationsmedlet. Minskningen av nox för den kemiska arten tyder på att den har minskat.
Ämnet som förlorar elektroner genomgår oxidation och är ett reduktionsmedel. Ökningen av nox för den kemiska arten indikerar att den har genomgått oxidation.
fråga 2
Exempel på redoxreaktioner i vardagen FÖRUTOM
a) Korrosion
b) förbränning
c) Fotosyntes
d) Neutralisering
Felaktigt alternativ: d) Neutralisering.
En neutraliseringsreaktion är en som sker mellan en syra och en bas, vilket resulterar i salt och vatten. Till exempel:
NaOH + HCl → NaCl + H2O
Exempel på en redoxreaktion är:
metanförbränning
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosyntes
6CO2(g) + 6H2O(v) → C6H12O6 (här) + 6O2(g)
järnkorrosion
2 Fe(s) + 3/4O2(g) + 3 timmar2O(v) → 2Fe (OH)3(s)
fråga 3
Observera följande oxidations-reduktionsreaktioner och ange vilka som är oxidations- och reduktionsmedlen.
jag. Zn0(s) + asså2+(här) → Zn2+(här) + asså0(s)
II. Röv2+(här) + H2(g) → 2H+(här) + asså(s)
III. Zn(s) + 2H+(här) → Zn2+(här) + H2(g)
Svar:
I en redoxreaktion är den som genomgår oxidation reduktionsmedlet och den som genomgår reduktion är oxidationsmedlet.
jag. Zn0(s) + asså2+(här) → Zn2+(här) + asså0(s)
Oxidationsmedel: koppar (Cu)
Reduktionsmedel: zink (Zn)
II. Röv2+(här) + H2(g) → 2H+(här) + asså(s)
Oxidationsmedel: koppar (Cu)
Reduktionsmedel: väte (H)
III. Zn(s) + 2H+(här) → Zn2+(här) + H2(g)
Oxidationsmedel: väte (H)
Reduktionsmedel: zink (Zn)
Få mer kunskap med innehållet:
- Vad är stackar?
- elektrokemi
- Elektrolys
Bibliografiska referenser
FONSECA, M. R. M Kemi, 2. 1. ed. São Paulo: Attika, 2013.
SANTOS, W.L.P; MOL, G.S. Medborgarkemi, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Anslut kemi, 2: kemi. - 2. ed. São Paulo: Saraiva, 2014.


