Osmos är rörelsen av vatten som äger rum inuti celler genom ett halvgenomträngligt membran.
I denna process rör sig vattenmolekylerna från ett mindre koncentrerat medium till ett mer koncentrerat medium.
Därför tjänar osmos till att balansera de två sidorna av membranet, vilket får det lösta ämnet att spädas ut med lösningsmedlet, vilket är vatten.
Hur uppstår osmos?
Osmos anses vara en passiv transport, som i passagen genom membranet ingen energi går till spillo.
I processen med osmos tenderar vatten, som är lösningsmedlet, att korsa det halvgenomträngliga membranet för att balansera koncentrationen av lösningen. Denna åtgärd utförs tills det osmotiska trycket har stabiliserats.
Därför rör sig vattnet från det mindre koncentrerade området till det mer koncentrerade, naturligt.
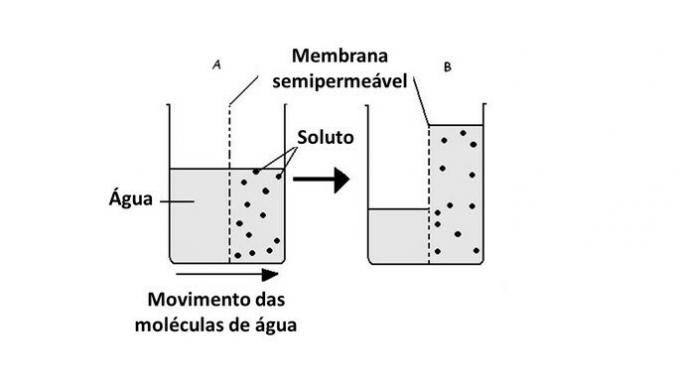
Vattenpassagen från ett medium till ett annat sker i celler med hjälp av transport av proteiner i membranet, aquaporiner. Således inträffar osmos när det finns en skillnad i koncentration mellan cellens yttre och inre miljö.
Resultatet av osmos används i näringsutbytesprocesserna hos djur- och växtceller.
Läs också om Passiv transport och Aktiv transport.
Hypotonisk, isotonisk och hypertonisk lösning
Som vi har sett syftar osmosprocessen till att utjämna koncentrationerna av lösningar tills en jämvikt uppnås. För detta har vi följande typer av lösningar:
- hypertonisk lösning: presenterar högre osmotiskt tryck och koncentration av löst ämne.
- hypotonisk lösning: presenterar lägre osmotiskt tryck och koncentration av löst ämne.
- isoton lösning: den lösta koncentrationen och det osmotiska trycket är lika och uppnår därmed jämvikt.
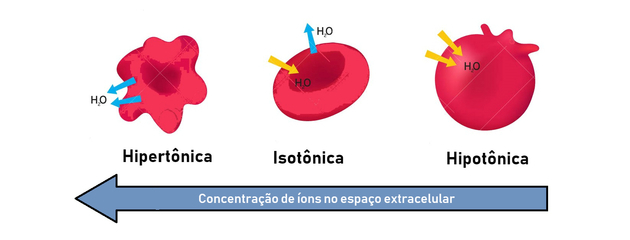
Därför uppstår osmos mellan ett hypertoniskt (mer koncentrerat) och hypotoniskt (mindre koncentrerat) sätt att skapa en balans.
exempel på osmos
I celler är plasmamembranet ett hölje som bildas av ett lipid-dubbelskikt som hindrar rörelsen av vatten i cellen. Det finns emellertid proteiner som är specialiserade i dess struktur, aquaporiner, som fungerar som kanaler som underlättar passage av vattenmolekyler.
I en hypertonisk miljö tenderar celler att krympa när de tappar vatten. En cell placerad i ett hypotoniskt medium kan svälla tills det går sönder, eftersom det rör sig vatten in i cellen.
Se nedan hur osmos uppträder i djur- och växtceller.
Osmos i djurceller
när en Djurcell, som röda blodkroppar, exponeras för media med olika koncentrationer, sker rörelsen av vatten i cellen enligt följande:
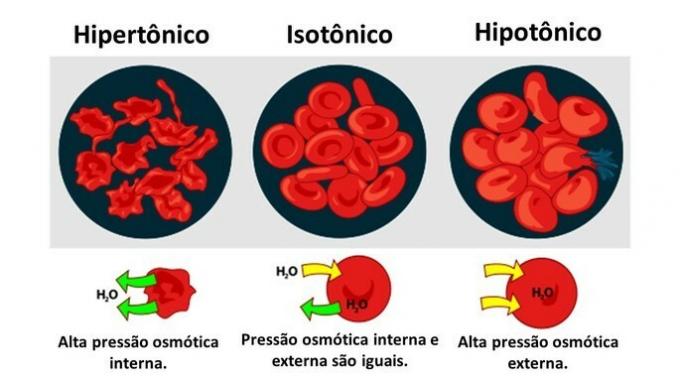
När mediet är rikt på löst ämne, en lösning som är hypertonisk med avseende på cytoplasman, förlorar celler vatten till mediet och försvinner.
När mediet är fattigt i löst ämne, en hypotonisk lösning, tenderar vattenmolekyler att tränga in i cellen och även om membranet är resistent, kan det uppstå störningar beroende på mängden.
Växtcellosmos
Förflyttningen av vatten i växtceller sker mellan den cellulära vakuolen och den extracellulära miljön.
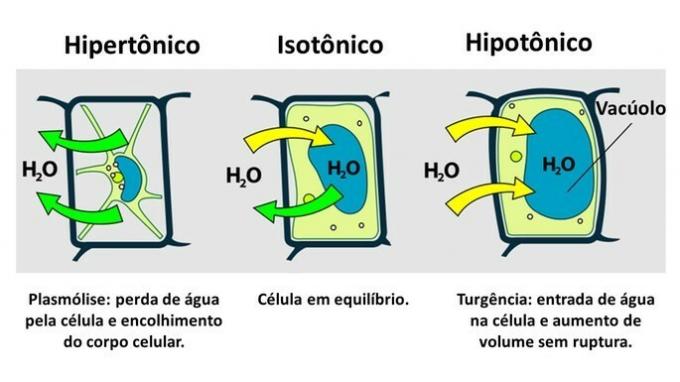
DE växtcell den har förutom plasmamembranet en mycket resistent cellvägg som bildas av cellulosa.
Därför, till skillnad från djurcellen, motstår växtcellen störningar när den sätts in i en hypotonisk miljö där vatten tenderar att komma in i cellen. Cellen sväller och ökar volymen men cellväggen förhindrar bristning.
Förlusten av vatten av en växtcell, som sätts in i en hypertonisk miljö, kallas plasmolys. Inträdet av vatten i vakuolen när cellen är i ett hypotoniskt medium kallas nödsituation när det finns en ökning av cellvolymen.
Hur påverkar osmotiskt tryck osmos?
En löst substans är vilken substans som helst som kan spädas i ett lösningsmedel, såsom socker upplöst i vatten. Medan osmotiskt tryck är trycket som görs för att vatten ska röra sig.
Eftersom osmos är en process som sker från det minst koncentrerade (hypotoniska) till det mest koncentrerade (hypertoniska) mediet i Sök efter balans, osmotiskt tryck är trycket som utövas på ett system för att förhindra osmos naturligtvis.
Ju större koncentrationsskillnaden mellan det hypertoniska och hypotoniska mediet är, desto större bör det osmotiska trycket appliceras på den mer koncentrerade lösningen för att undvika osmos.
Lära sig mer om osmotiskt tryck.
Vad är omvänd osmos och hur det fungerar
Omvänd osmos är passage av vatten i motsatt riktning till osmos. Således rör sig vatten från en mer koncentrerad lösning till en mindre koncentrerad.
Omvänd osmos sker genom att applicera ett tryck som är större än det naturliga osmotiska trycket.
Eftersom det halvgenomträngliga membranet endast tillåter passage av lösningsmedel (rent vatten), kvarhåller det lösta ämnen.
Ett exempel på omvänd osmos är omvandlingen av saltvatten till sötvatten genom avsaltningsprocessen.
Lära sig mer om omvänd osmos.
Skillnad mellan osmos och diffusion
Diffusion är passage av mycket små molekyler av gaser och lösta ämnen lösta i vatten genom plasmamembran. I detta fall kommer de lösta molekylerna att flytta från det mer koncentrerade mediet till det mindre koncentrerade. De rör sig för en koncentrationsgradient och sprider sig i det tillgängliga utrymmet.
DE underlättade diffusion det är passagen genom membranet av ämnen som inte löser sig i lipider, med hjälp av proteiner som genomsyrar lipid-dubbelskiktet.
Liksom osmos anses diffusion också vara en passiv transport, eftersom det sker till förmån för en koncentrationsgradient.
Nyfikenhet
Uttrycket "lärande med osmos" används ofta av studenter som vill lära sig nytt innehåll utan att behöva studera, det vill säga utan att göra en ansträngning.
Läs också:
- Lösningsmedel och lösningsmedel
- Natrium- och kaliumpump
- Selektiv permeabilitet



