Tänk på den generiska reversibla reaktionen nedan, där små bokstäver motsvarar de balanserade reaktionskoefficienterna och stora bokstäverna är reaktanterna och produkterna är alla gasformiga:

Med tanke på var och en av reaktionsriktningarna separat ges deras utvecklingshastigheter (Td) av:
* Direkt reaktion: aA + bB → cC + dD
Alltdirekt = Kdirekt. [DE]De. [B]B
* Omvänd reaktion: cC + dD → aA + bB
Alltomvänd = Komvänd. [Ç]ç. [D]d
Den kemiska jämviktskonstanten i termer av koncentration i kvantitet av materien (Kç) och i termer av partiellt tryck (KP) ges genom att dela Kdirekt av Komvänd.
Så vi har:
Kdirekt. [DE]De. [B]B = 1 → Kdirekt__ = __[Ç]ç. [D]d___
Komvänd. [Ç]ç. [D]d Komvänd [DE]De. [B]B
Att vara, Kç =_Kdirekt_
Komvänd
Så vi har:
Kç =__[Ç]ç. [D]d___ eller KP =__(Praça)ç. (pD)d___ |
Där p är partialtrycket för varje ämne vid jämvikt.
På detta sätt höjs varje koncentration till en exponent som motsvarar koefficienten för respektive substans i reaktionen, och Kç har inte enhet *.
Dessutom är en mycket viktig aspekt att belysa i detta uttryckvarken fasta komponenter eller rena vätskor bör representeras., eftersom endast saker som kan drabbas av variation deltar i detta uttryck. Koncentrationen i mängden materia av ett ämne i fast tillstånd är konstant och är således redan inkluderad i själva K-värdet.ç. Detsamma gäller rena vätskor som vatten. Kortfattat, endast ämnen i gasformigt tillstånd och i vattenlösning deltar i uttrycket.
Sluta inte nu... Det finns mer efter reklam;)
Notera exemplen nedan:
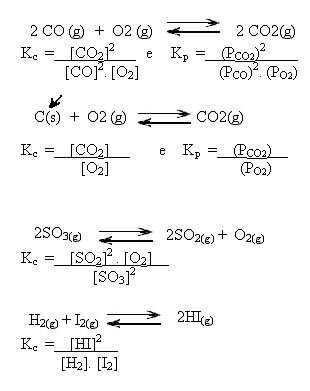
K-värdenç kan visa om koncentrationen av reaktanter och produkter är densamma eller om den ena är större än den andra:
- om Kç eller KP är lika med en (Kç = 1)betyder detta att koncentrationen av reaktanter och produkter är lika;
- om värdet av Kç eller KP vara långbetyder detta att produkterna är i större koncentration, för i uttrycket av Kç produkterna finns i täljaren;
- om värdet av Kç eller KP är lågbetyder detta att reagensen är i högre koncentration, för i uttrycket av Kç reagensen är i nämnaren.
* Kç och KP de är dimensionlösa tal, det vill säga rena tal, utan någon enhet relaterad till någon storlek eller relation mellan magnituder.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Jämviktskonstanter Kc och Kp"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Åtkomst den 28 juni 2021.


