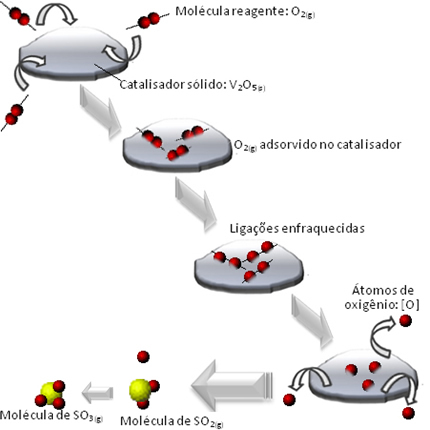
Kemisk kinetik studerar hastigheten för kemiska reaktioner och de faktorer som påverkar hastigheten för dessa reaktioner.
Använd frågorna nedan för att testa dina kunskaper och kolla in kommentarerna till resolutionerna.
fråga 1
Beträffande de faktorer som påverkar hastigheten för en kemisk reaktion är det INKORREKT att säga att:
a) Ju högre koncentrationen av reaktanter är, desto snabbare blir reaktionen.
b) Ju större kontaktyta, desto högre reaktionshastighet.
c) Ju högre tryck desto snabbare blir reaktionen.
d) Ju högre temperatur, desto snabbare blir reaktionen.
e) Närvaron av en katalysator håller reaktionshastigheten konstant.
Felaktigt alternativ: e) Närvaron av en katalysator håller reaktionshastigheten konstant.
Katalysatorer ökar reaktionshastigheten, eftersom de underlättar bildandet av det aktiverade komplexet mellan reaktanterna.
Med detta skapar katalysatorerna en kortare mekanism för reaktionens utveckling, vilket får hastigheten att öka.
fråga 2
Enligt _____________ måste effektiva kollisioner inträffa mellan reagenserna för att bilda produkterna. Dessutom finns det tillräckligt med ___________ för att bryta de kemiska bindningarna i reaktanterna och bilda en ___________, vilket är ett mellanliggande tillstånd före bildandet av produkter.
Orden som fyller i blankorna är:
a) entalpi, kinetisk energi och katalysatorvariation.
b) kollisionsteori, aktiveringsenergi och aktiverat komplex.
c) reaktionshastighet, entalpi och hämmare.
d) partiellt tryck, entropi och substrat.
Rätt alternativ: b) kollisionsteori, aktiveringsenergi och aktiverat komplex.
Enligt kollisionsteorin är kollisionerna mellan reaktanterna nödvändiga för att en kemisk reaktion ska inträffa. För detta måste ämnena vara i en gynnsam position för att chockerna ska vara effektiva.
Aktiveringsenergi fungerar som en energibarriär som måste övervinnas för att bryta bindningarna hos reagerande föreningar. Ju lägre aktiveringsenergi desto snabbare är reaktionen.
Det aktiverade komplexet är en instabil mellanliggande art bildad före produkterna.
fråga 3
Följande fyra uttalanden görs om katalysatorer:
I. En katalysator fungerar genom att öka hastigheten för en reaktion, men den ändrar inte dess prestanda.
II. Vid en kemisk reaktion förbrukas inte katalysatorn i reaktionsvägen.
III. Katalysatorer skapar en alternativ väg för att omvandla reaktanter till produkter. För detta behövs större aktiveringsenergi.
IV. Katalysatorn kan bara påskynda reaktionen framåt.
Alternativen som visar korrekt information om katalysatorer är:
a) I och II
b) II och III
c) I och IV
d) Alla
Rätt alternativ: a) I och II.
Katalysatorer används för att påskynda kemiska reaktioner. Reaktionen med användning av katalysatorn ändrar inte dess utbyte, det vill säga den förväntade mängden av produkten produceras, men på kortare tid.
Katalysatorer förbrukas inte under den kemiska reaktionen, de hjälper till att bilda det aktiverade komplexet. Därför kan en katalysator utvinnas i slutet av den kemiska reaktionen.
Katalysatorer kan minska reaktionstiden genom att skapa en alternativ mekanism för bildandet av produkter med lägre aktiveringsenergi. Därför sker reaktionen snabbare.
Katalysatorer verkar både framåt och i omvänd riktning av reaktionen.
fråga 4
Hur snabbt en kemisk reaktion äger rum beror på:
I. Antal effektiva kollisioner mellan reagenser.
II. Tillräckligt med energi för att omorganisera atomerna.
III. Gynnsam orientering av molekyler.
IV. Bildande av ett aktiverat komplex.
a) I och II
b) II och IV
c) I, II och III
d) I, II, III och IV
Rätt alternativ: d) I, II, III och IV.
Effektiva kollisioner inträffar när reaktanterna är i positioner som är gynnsamma för chocker, vilket kommer att främja omarrangeringen av atomer.
Aktiveringsenergin måste vara tillräcklig för att kollisionen mellan reaktanterna ska leda till att bindningar bryts och bildandet av det aktiverade komplexet.
Inte alla kollisioner mellan reagerande partiklar får reaktionen att äga rum. Orienteringen med vilken kollisionen inträffar är viktig för att produkterna ska bildas.
Det aktiverade komplexet är ett mellanliggande och instabilt tillstånd före bildandet av produkter. Den skapas när aktiveringsenergin för reaktionen överskrids.
fråga 5
Koldioxid är en gas som bildas genom reaktionen mellan kolmonoxid och syrgas enligt den kemiska ekvationen nedan.
CO(g) + ½2 (g) → CO2 (g)
Att veta att i 5 minuters reaktion förbrukades 2,5 mol CO, vad är hastigheten för reaktionens utveckling enligt konsumtionen av O2?
a) 0,2 mol. min-1
b) 1,5 mol. min-1
c) 2,0 mol. min-1
d) 0,25 mol. min-1
Rätt alternativ: d) 0,25 mol. min-1
För att svara på denna fråga måste vi titta på den kemiska ekvationen.
CO(g) + ½2 (g) → CO2 (g)
Observera att 1 mol kolmonoxid reagerar med ½ mol syre och bildar 1 mol koldioxid.
Mängden som anges i uttalandet hänvisar till kolmonoxid, men svaret måste vara termer av syre. För detta måste vi utföra en regel på tre och hitta mängden syre.
1 mol CO - ½ mol O2
2,5 mol CO - x av O2
x = 1,25 mol
Nu tillämpar vi värdena i formeln för reaktionsutvecklingshastigheten.
Därför är reaktionsutvecklingshastigheten med avseende på syre 0,25 mol.min-1.
fråga 6
Notera den grafiska representationen av utvecklingen av en hypotetisk kemisk reaktion, som relaterar energi och reaktionsväg.
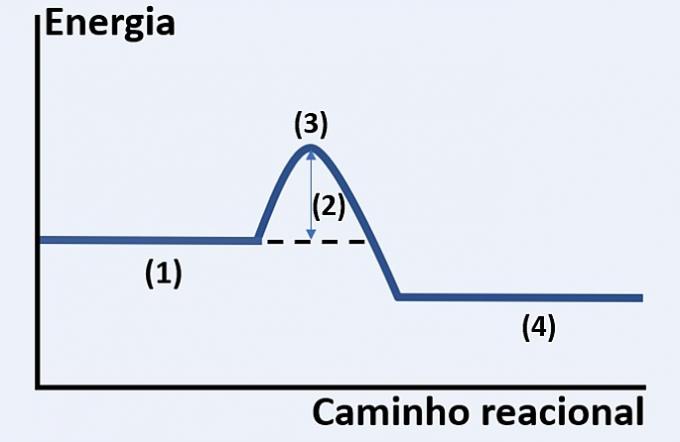
Kontrollera alternativet som korrekt ersätter (1), (2), (3) respektive (4).
a) substrat, frisläppt värme, maximalt energitillstånd och reaktionens slut.
b) reagens, aktiveringsenergi, aktiverat komplex och produkter.
c) reaktanter, kinetisk energi, katalysator och substrat.
d) reaktanter, absorberad värme, termisk energi och produkter.
Rätt alternativ: b) reagenser, aktiveringsenergi, aktiverat komplex och produkter.
Diagrammet som visas är av en endoterm reaktion, det vill säga det finns energiabsorption för att reaktionen ska inträffa.
Du reagens (1) är i början av diagrammet och aktiverings energi (2) motsvarar skillnaden mellan den energi som lagras i reaktanterna och i komplex aktiverat (3). Slutligen, efter att ha passerat mellantillståndet, bildandet av Produkter (4).
Därför måste reaktanterna övervinna aktiveringsenergin för att omorganisera sina atomer till en mellanstruktur som kallas ett aktiverat komplex för att produkterna ska bildas.
fråga 7
Ämne A kan brytas ned och bli ämne B. Observera utvecklingen av denna reaktion i bilden nedan.

När det gäller reaktionshastigheten kan vi säga att:
a) Ämne A sönderdelas mellan 0 och 15 s med en hastighet av 0,35 mol.s-1.
b) Ämne A sönderdelas mellan 15 och 30 s med en hastighet av 0,02 mol.s-1.
c) Ämne A sönderdelas mellan 0 och 15 s med en hastighet av 0,04 mol.s-1.
d) Ämne A sönderdelas mellan 15 och 30 s med en hastighet av 0,03 mol.s-1.
Rätt alternativ: d) Ämne A sönderdelas mellan 15 och 30 s med en hastighet av 0,03 mol.s-1.
Nedbrytningshastigheten för ämne A kan beräknas med formeln:
Låt oss beräkna reaktionshastigheten i termer av ämne A mellan de angivna intervallen.
Område mellan 0 och 15:
Område mellan 15 och 30:
Därför är alternativ d korrekt, eftersom ämne A sönderdelas mellan 15 och 30 s med en hastighet av 0,03 mol.s.-1.
fråga 8
Tänk på följande hypotetiska reaktion.
aA + bB → cC + dD
Notera variationen i koncentrationen av A och C nedan.
| Tid | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Förbrukning av A (mol / l) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Bildning av C (mol / L) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Baserat på informationen i frågan, vad är respektive förbrukningshastighet för A och bildningshastigheten för C i intervallet mellan 5 och 25 min?
a) 0,3 mol. L-1.s-1 och 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 och 0,3 mol. L-1.s-1
c) - 0,25 mol. L-1.s-1 och 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 och 0,3 mol. L-1.s-1
Rätt alternativ: c) - 0,25 mol. L-1.s-1 och 0,1 mol. L-1.s-1.
En konsumtionsgrad:
C träningshastighet:
Därför förbrukas A i reaktionen med en hastighet av 0,25 mol.s-1, så dess värde är negativt, medan B bildas med en hastighet av 0,1 mol. L-1.s-1.
Läs också:
- Kemisk kinetik
- termokemi
- Kemisk balans
- Kemiska reaktioner