En katalysators verkan är i grunden att påskynda utvecklingen av en viss reaktion. Detta är möjligt eftersom katalysatorn ändrar mekanismen genom vilken reaktionen fortskrider, vilket leder till en "alternativ väg" som kräver mindre aktiveringsenergi för att reaktionen ska starta och nå det aktiverade komplexet.
Det finns flera typer av katalys, varav en är heterogen katalys, som kan definieras som det som inträffar när systemet har mer än en fas, det vill säga reaktanterna och produkterna är i ett fysiskt tillstånd som skiljer sig från det fysiska tillståndet hos katalysatorn.
Ett exempel vi kan nämna är ett mellansteg av svavelsyrabildning (H2ENDAST4 (aq)). Detta steg består av bildandet av svaveltrioxid (SO3 (g)) genom förbränningsreaktionen av svaveldioxid (SO2 (g)):
2 SÅ2 (g) + O2 (g) → 2 OS3 (g)
När denna reaktion fortskrider så långsamt används en katalysator för att påskynda den. En katalysator som kan användas i detta fall är divanadiumpentoxid (V2O5 (S)), som är fast. Eftersom reaktanterna och reaktionsprodukten är gasformiga kommer vi att ha ett heterogent system.
Men hur kan divanadiumpentoxid påskynda reaktionen?
Vad som händer är att syrereagensmolekylerna adsorberas, dvs kvar på ytan av divanadiumpentoxiden. Detta gör att bindningarna av molekylerna i denna gas försvagas med tiden, vilket underlättar bildandet av komplexet aktiveras och minskar följaktligen aktiveringsenergin för reaktionen, vilket ökar dess utvecklingshastighet, det vill säga dess hastighet.
Sluta inte nu... Det finns mer efter reklam;)
Se hur detta händer i diagrammet nedan:
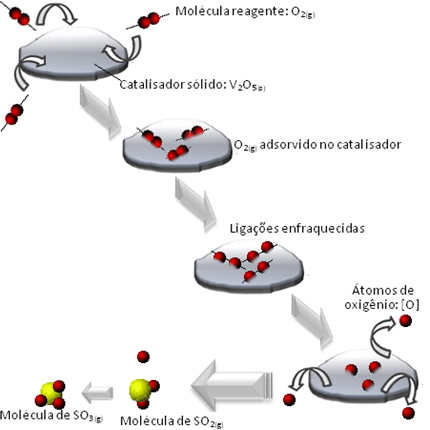
Andra exempel på heterogen katalys visas nedan. Observera att i båda fallen är reaktanterna och produkterna i gasformigt, vattenhaltigt eller flytande tillstånd, medan katalysatorerna är i fast tillstånd:
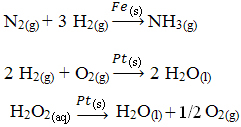
Ett exempel på heterogen katalys som sker i våra dagliga liv är omvandlare bilkatalytisk, mer känd som katalysatorer. Dessa föroreningsskydd är belagda med ämnen som fungerar som katalysatorer vanligtvis en legering av palladium och rodium (för bensinmotorer) och palladium och molybden (för bensinmotorer). alkohol).
Inom denna katalysator uppträder kemiska reaktioner där gaser från ofullständig förbränning, som är mer skadliga för människor, omvandlas till giftfria gaser. Reaktanter och produkter är alla gaser, medan katalysatorer är fasta ämnen.
För att förstå mer om operativsystem för denna utrustning, läs texten: "Katalytisk omvandlare”.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Heterogen katalys"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/catalise-heterogenea.htm. Åtkomst den 27 juni 2021.



