Som förklaras i texten “Katalys och katalysator”, Katalysatorer är kemiska arter som påskyndar reaktionshastigheten. Dess användning är mycket användbar inom kemisk industri, där man försöker spara så mycket tid som möjligt i produktionen.
I vissa situationer är det dock mer intressant att reaktionen går långsammare; som till exempel när du vill bestämma hastigheten för mycket snabba reaktioner. För att uppnå denna bedrift, kontrollera och studera dessa reaktioner, är det vanligt att lägga till ett ämne som saktar ner reaktionerna, som kallas hämmare, gifter eller antikatalysatorer.
Dessa kemiska arter kombineras med katalysatorn, vilket upphäver eller minskar dess verkan. Detta är möjligt eftersom katalysatorns verkningsmekanism är att minska aktiveringsenergin, underlätta reaktionsprocessen och öka dess hastighet; redan hämmare verkar omvänt, vilket innebär att de ökar aktiveringsenergin som behövs för att reaktanter ska nå det aktiverade komplexet.
Ett exempel som kan nämnas är arsenik (As), som har denna funktion i Haber-Bosch-reaktionen, en reaktion som i stor utsträckning används inom industrin för produktion av ammoniak med järn (Fe
(s)) som katalysator. Således blir järnens effektivitet väldigt liten i närvaro av arsenik, vilket hämmar det, det vill säga det är katalysatorgiftet i denna reaktion, vilket visas nedan: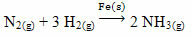
Arsenik kan också utöva en antikatalytisk verkan när man använder metallisk platina (Pt(s)) som en katalysator för SO-förbränningsreaktionen2 (g), för produktion av svaveltrioxid (SO3 (g)). Närvaron av arsenik, även i små mängder, avlägsnar den katalytiska verkan av platina, vilket kan förlama en del av produktionen. Det är därför som normalt används i industrier som hanterar denna produktion divanadiumpentoxid (V2O5 (s)) som en katalysator i stället för platina.
Sluta inte nu... Det finns mer efter reklam;)
Ett annat exempel inträffar vid följande väteperoxidnedbrytningsreaktion:
2 timmar2O2 (aq) → 2 H2O(1) + 1 O2 (g)
I detta fall är en hämmare som kan användas viss syra, för när mediet är surt fortsätter reaktionen långsammare.
Men hämmaren används också i stor utsträckning av industrin, främst för att fungera som en reaktionshämmare av den naturliga nedbrytningen av livsmedel, drycker, kosmetika och läkemedel.
Kosmetika kan till exempel ta lång tid att nå konsumenten; sålunda används olika konserveringsmedel i dem, såsom propylparaben, som används i oljefasen och fungerar som ett antisvamp, och metylparaben, som används i vattenfasen och som har en antiseptisk effekt. Deras respektive strukturer visas nedan:
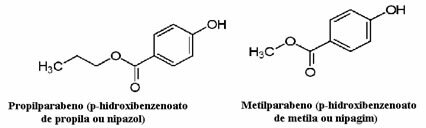
Det är intressant att det på många kosmetiska etiketter finns följande fras: ”Det innehåller inte parabener”. Detta innebär att denna kosmetika inte har dessa konserveringsmedel som vi nämnde och att de normalt inte har testats på djur.
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i ett skola eller akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Katalysatorinhibitorer"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm. Åtkomst den 27 juni 2021.


