Elektrolys är en fysikalisk-kemisk process som använder elektrisk energi från vilken källa som helst (t.ex. batteri eller batteri) för att tvinga förekomsten av en kemisk reaktion att producera enkla eller sammansatta ämnen som inte finns i naturen eller som inte finns i stora mängder.
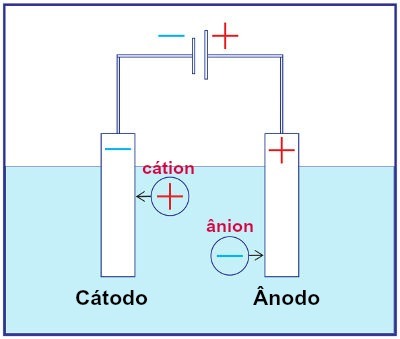
Representation av monteringen av alla elektrolyssystem
Under elektrolys genomgår en katjon minskning vid katoden och en anjon genomgår oxidation vid anoden. Detta händer genom elektrisk urladdning från en extern källa. Således har vi i elektrolys en icke-spontan oxidations- och reduktionsreaktion.
Förstå nu de två sätt på vilka elektrolys sker:
I denna typ av elektrolys använder vi a joniskt ämne i flytande tillstånd i ett elektrolytiskt kärl. När den joniska substansen (XY) genomgår fusion, genomgår den processen dissociation, som visas nedan:
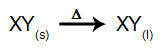

Sedan, när strömkällan är påslagen, kommer katjonen (X+) rör sig mot katoden och anjonerna (Y-) flytta mot anoden. Därigenom:
Vid katoden: katjonerna tar emot elektroner (de genomgår reduktion) och förvandlas till en stabil substans (X), en process som representeras av följande ekvation:
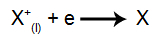
Vid anoden: anjoner förlorar elektroner (de genomgår oxidation) och blir en stabil substans (X), en process som representeras av följande ekvation:

a) Exempel på magmatad elektrolys
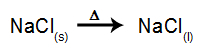
Som ett exempel, följ nu den magmatiska elektrolysen av natriumklorid (NaCl). När natriumklorid (NaCl) genomgår fusion genomgår det dissociationsprocessen, som visas nedan:
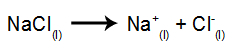
Sedan, när strömkällan är påslagen, katjonen (Na+) rör sig mot katoden och anjonerna (Cl-) flytta mot anoden. Därigenom:
Vid katoden: katjonerna i+ de tar emot elektroner (de genomgår reduktion) och blir en stabil substans (Na, som är en fast metall), en process som representeras av ekvationen nedan:

Vid anoden: Cl-anjonerna- de förlorar elektroner (de genomgår oxidation) och blir en stabil substans (Cl2, som är gasformig), process som representeras av ekvationen nedan:

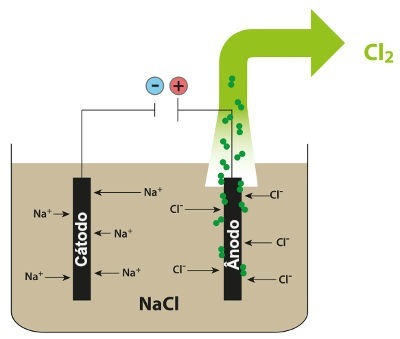
Schema som visar den magmatiska elektrolysen av NaCl
Således har vi i den magmatiska elektrolysen av natriumklorid bildning av metalliskt natrium (Na) och klorgas (Cl2).
I denna typ av elektrolys använder vi ett joniskt ämne upplöst i vatten, inne i elektrolytbehållaren. Så innan vi utför elektrolysen, blandar vi först ämnet (vanligtvis ett salt oorganiskt) i vatten för att orsaka dess dissociation (frisättning av en katjon och en anjon), såsom visas vrål:
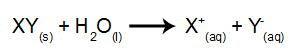
Skillnaden i förhållande till magmatisk elektrolys är att vi förutom jonerna från dissociation också har joner från självjoniseringen av vatten. I sin självjonisering producerar vatten en hydroniumkatjon (H+och en hydroxidanjon (OH-), som i ekvationen nedan:

Inom det elektrolytiska kärlet har vi alltså närvaron av två katjoner (en från substansen jonisk och en från vatten) och två anjoner (en från den joniska substansen och den andra från Vatten).
För att veta vilken katjon som kommer att flytta till katoden och vilken anjon som kommer att flytta till anoden, är det nödvändigt att veta ordningen för urladdning av katjoner och anjoner.
För katjoner:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hydronium> IIIA-familj> IIA-familj> IA-familj
för anjoner
Icke-syresatta anjoner och HSO4 > hydroxid> syresatta anjoner och F
Sedan, när strömkällan är påslagen, kommer en katjon (X+) rör sig mot katoden och en av anjonerna (Y-) rör sig mot anoden.
Vid katoden: katjonerna tar emot elektroner (de genomgår reduktion) och förvandlas till en stabil substans (X), en process som representeras av ekvationen nedan:

Vid anoden: anjoner förlorar elektroner (de genomgår oxidation) och blir en stabil substans (Y), en process som representeras av ekvationen nedan:
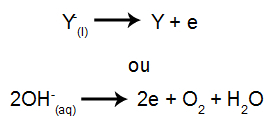
a) Exempel på vattenhaltig elektrolys
Som ett exempel kommer vi att använda den vattenhaltiga elektrolysen av natriumklorid (NaCl). När natriumklorid (NaCl) löses i vatten genomgår det dissociationsprocessen, som visas nedan:
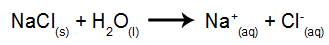
Förutom dissociationen av NaCl har vi självjonisering av vatten:

Så vi har H-katjoner+ och igen+ och OH-anjonerna- och Cl-. Sedan, när strömkällan är påslagen, har vi följande:
vid katoden: H-katjonerna+ ta emot elektroner (reducerad) och bli en stabil substans (H2, vilket är en gas). Detta beror på att hydronium har urladdningsprioritet framför elementen i IA-familjen (i det här fallet Na). Processen representeras av ekvationen nedan:
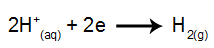
vid anod: Cl-anjonerna- de förlorar elektroner (de genomgår oxidation) och blir en stabil substans (Cl2, vilket är gasformigt). Detta beror på att Cl- det är en icke-syresatt anjon och har urladdningsprioritet framför hydroxid, en process som representeras av ekvationen nedan:


Schema som visar den vattenhaltiga elektrolysen av NaCl
Således har vi i den vattenhaltiga elektrolysen av natriumklorid bildandet av vätgas (H2och klorgas (Cl2).
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm

