En reversibel reaktion som är i balans kommer bara att flytta sin balans om det sker någon extern förändring, eftersom en balans aldrig skiftar av sig själv.
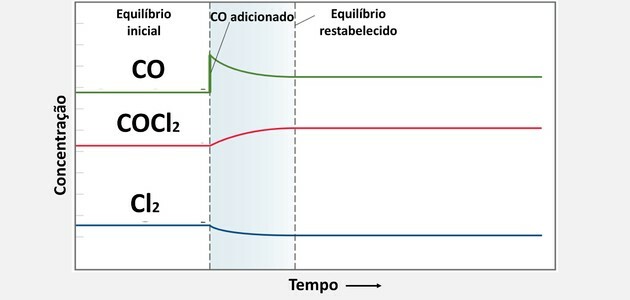
En sådan förändring är koncentrationsvariation, vilket innebär att man tar bort eller tillsätter reagens eller produkter.
Låt oss titta på ett exempel:

- Tillsats av reagens:
Om vi lägger till mer vätgas eller mer kvävgas till jämvikten kommer reaktanternas koncentrationer att öka och därmed antalet effektiva chocker mellan deras molekyler kommer också att öka, vilket resulterar i en ökad utvecklingshastighet för den direkta ammoniakbildningsreaktionen (NH3 (g)).
Detta innebär att tillsatsen av reagens flyttar balansen till höger sida mot bildandet av produkter:

Detta är i enlighet med Principen för Le Chatelier som säger det när någon störning orsakas i ett system i jämvikt rör sig det i riktning för att avbryta denna störning och försöker anpassa sig till en ny jämvikt.
I fallet ovan kommer det att hända att ammoniakmängden med tiden kommer att öka och nå en jämvikt igen. Således kommer förhållandet mellan koncentrationerna av produkter och reagens att förbli konstant, det vill säga värdet på jämviktskonstanten Kc förblir densamma.
Kc = __ [NH3]2__↑
[N2]. [H2]3 ↑
Detta kommer också att hända för de andra fallen, det vill säga ingen variation i koncentrationen av reagens eller produkter kommer att ändra Kc-värdet.
- Tillsats av produkter:
Om vi lägger till mer ammoniak och ökar koncentrationen blir en del av det till gaser kväve och väte, vilket ökar utvecklingshastigheten för den omvända reaktionen vid bildandet av reagens.
Sluta inte nu... Det finns mer efter reklam;)
Detta innebär att tillsatsen av produkter flyttar balansen åt vänster mot bildandet av reagens:

- Avlägsnande av reagens:
Om vi avlägsnar en eller båda reagenserna kommer deras koncentrationer att minska och följaktligen minskar utvecklingshastigheten för den direkta reaktionen. Således kommer balansen att flyttas mot bildandet av fler reaktanter, vilket är till vänster:

- Produktuttag:
Om vi minskar koncentrationen av produkter kommer hastigheten för den omvända reaktionen att minska, vilket ökar utvecklingshastigheten för den framåtriktade reaktionen. Detta innebär att balansen kommer att flyttas åt höger:

Kort sagt kan vi säga följande:

Det är viktigt att betona att variation i koncentrationen av fasta ämnen förändrar inte jämvikten.
Så, i reaktionen nedan, om vi tar bort eller lägger till CO2 (g) eller CO(g), kommer en balansförskjutning att ske. Men om vi minskar eller lägger till C(s), ingenting kommer att hända med kemisk balans:
Ç(s) + CO2 (g) CO 2 CO(g)
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Variation av koncentration och förskjutning av kemisk jämvikt"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/variacao-concentracao-deslocamento-equilibrio-quimico.htm. Åtkomst den 28 juni 2021.