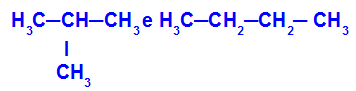Isomeri det är ett naturfenomen där olika ämnen (i termer av kemiska och fysikaliska egenskaper) har exakt samma molekylformel, som i följande exempel:
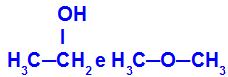
Olika ämnen som har samma molekylformel
Etanol (till vänster) har molekylformeln C2H6O, som också förekommer med metoxietan (till höger), så de är isomerer.
Typer av isomerism
→ platt isomer
Det är den typ av isomerism som studerar de strukturella skillnaderna mellan isomerer.
De) Ockupation
Det är den typ av platt isomerism där skillnaden mellan ämnen baseras på skillnaden mellan de organiska funktioner som de tillhör. Se några exempel:
Propanon och propan:
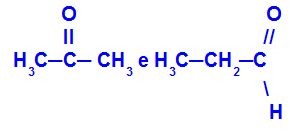
Isomerer som tillhör olika funktioner
Propanon (vänster) tillhör ketongruppen och propanal (höger) tillhör aldehydgruppen.
B) Fängelse
Det är den typ av platt isomerism där skillnaden mellan ämnen baseras på skillnaden mellan kedjorna de presenterar. Se ett exempel:
2-metyl-propan och butan
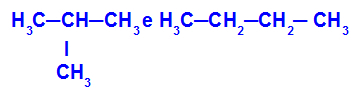
Isomerer som har kedjor med olika klassificeringar
I exemplet kan vi se att 2-metyl-propan (till vänster) har en grenad kedja och butan (till höger) har en normal kedja.
ç) Placera
Det är den typ av platt isomerism där skillnaden mellan ämnen baseras på skillnaden i position för en komponent som finns i deras kedjor. Se ett exempel:
1-klorpropan och 2-klorpropan
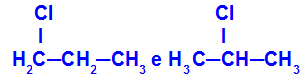
Isomerer som har komponenter på olika positioner i kedjan
I exemplet kan vi se att 1-klorpropan (till vänster) har klor placerat på kol 1 och 2-klorpropan (till höger) har klor placerat på kol 2.
d) Metameria eller ersättning
NOTERA: Isomer gäller endast för heterogena strängar.
Det är den typ av platt isomerism där skillnaden mellan ämnena baseras på skillnaden i positionen för en heteroatom som finns i deras kedjor. Se ett exempel:
Exempel: Metoxipropan och etoxietan
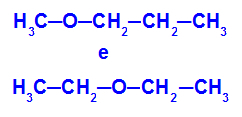
Isomerer som har heteroatomer vid olika positioner i kedjan
I exemplet kan vi se att syre i metoxipropan (till vänster) har en radikal med en kol på ena sidan och tre kol på den andra. I etoxietan (till höger) har syre en radikal med två kol på ena sidan och två kol på den andra.
och)Tautomery
Det är ett särskilt fall av isomerism av planfunktion och förekommer endast i tre organiska funktioner:
Aldehyd
keton
Enol
Denna typ av isomerism fungerar på det faktum att det finns en kemisk balans mellan enol och en aldehyd och mellan enol och en keton, det vill säga dessa komponenter omvandlas ständigt till varandra. Se ett exempel:
Prop-2-en-1-ol och propanon
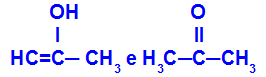
Isomerer som tillhör olika funktioner
I exemplet kan vi se att Prop-2-en-1-ol (till vänster) tillhör gruppen enoler och propanon (till höger) tillhör gruppen ketoner, så de är isomerer av tautomery.
→ Rymdisomerism
Det är en typ av isomerism som definieras av den rumsliga analysen av molekylen.
a) Geometriska isomerer
Sluta inte nu... Det finns mer efter reklam;)
Det är en typ av rumslig isomerism som uppstår när ämnet har molekyler med följande egenskaper:
Sluten kedja som har två kolatomer med två olika ligander, som i exemplet nedan:

Stängd struktur med geometrisk isomerism
Öppen kedja som har en dubbelbindning mellan kol och i vart och ett av dessa kol i dubbelbindningen finns det två olika ligander, som i exemplet nedan:
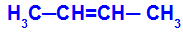
Öppen struktur med geometrisk isomerism
Geometrisk isomerism är uppdelad i två grupper:
1O Grupp: cis-trans
Det inträffar när de två liganderna i ett kol är strikt lika med de två liganderna i det andra kolet, antingen i den öppna strukturen eller i den slutna strukturen.
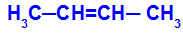
Kedja av ett ämne som har cis-trans-isomeri
Isomeren kommer att kallas cis när samma ligander är i samma plan.

Exempel på en cis-isomer
Isomeren kommer att kallas trans när de olika liganderna är i samma plan.

Exempel på en trans-isomer
2O Grupp: E-Z
Det inträffar när de två liganderna av ett kol är olika i förhållande till de två liganderna för det andra kolet, antingen i den öppna strukturen eller i den slutna strukturen.

Kedja av ett ämne som har E-Z-isomerism
Isomeren kommer att kallas E när liganderna med det högsta atomnummeret är i motsatta plan. I exemplet nedan har kolet till vänster Br med det högsta atomnummeret (35) och i det andra finns det syre (8).
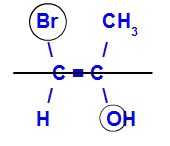
Exempel på en E-isomer
Isomeren kommer att kallas Z när liganderna med det högsta atomnummeret är i samma plan. I exemplet nedan har kolet till vänster Br med det högsta atomnummeret (35) och i det andra finns det syre (8).

Exempel på en Z-isomer
B) optisk isomer
Det är en typ av rumslig isomerism som bara uppstår om ämnet har molekyler med kiralt kol (den som har fyra olika ligander) i sina strukturer. Molekylen med kiralt kol har förmågan att polarisera och avböja ljus enligt följande:
Till höger (höger isomer)
Till vänster (levorotatorisk isomer)
En förening med optisk aktivitet har alltid aktiva isomerer (kallas optiska antipoder) och inaktiva isomerer (blandning mellan två aktiva isomerer, en blandning som kallas racemisk).
Vi kan använda följande formel för att bestämma antalet aktiva (IOA) och inaktiva (IOI) isomerer av en förening som har kiralt kol:
IOA = 2Nej
IOI = 2Nej
2
Nedan följer ett exempel på en förening som har geometrisk isomerism:
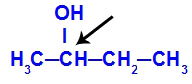
Kiralt kol med butan-2-ol
Strukturen för butan-2-ol har följande ligander:
Metyl (CH3)
Etyl (CH3-CH2)
Väte (H)
Hydroxyl (OH)
Eftersom det bara har ett kiralt kol har butan-2-ol därför:
Aktiva isomerer:
IOA = 21
IOA = 2
Inaktiva isomerer:
IOI = 21
2
IOI = 2
2
IOI = 1
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Vad är isomerism?"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Åtkomst den 27 juni 2021.