I tilläggsreaktioneri alkener(kolväten som har en dubbelbindning mellan två kolatomer), en pi-bindning mellan två kol bryts och var och en av kolerna fäster vid en ny atom. Se:
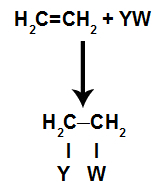
Allmän schematisk modell för en tilläggsreaktion
Principer för en tilläggsreaktion
a) Brott av pi-länk
Ett pi-band bryts lätt eftersom det är ett svagare band än ett sigma-band. För att detta ska ske är det emellertid nödvändigt att alkenen utsätts för betingelser som ger denna paus. Efter att ha brutit pi-bindningen mellan två kolatomer visas alltid ett bindningsställe (för nya atomer) på vart och ett av de inblandade kolerna.
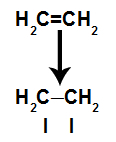
Schematisk bild av pi-länkbrott
b) Villkor för att bryta en pi-obligation
De faktorer som gynnar brytningen av en pi-obligation är:
Användning av katalysatorer;
Uppvärmning;
Närvaro av en syra i reaktionsmediet.
c) Förekomsten av tillsatsreaktionen
Bindningsställena som skapas efter det att pi-bindningen har brutits kommer alltid att upptas av atomer i reaktanten som är i samma behållare som alkenen. Tillsatsreaktionen är uppkallad efter typen av reagens blandat med alkenet.
Typer av tilläggsreaktioner i Alkenes
a) Hydrogenering
En alken blandas med vätgas (H2i en behållare och utsattes för verkan av en fast katalysator (nickel, platina eller palladium) och upphettning (A).
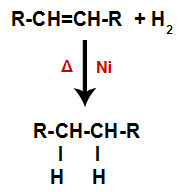
Allmänt schema för en hydreringsreaktion i alkener
Närvaron av katalysatorn och uppvärmningen orsakar pi-bindningen av alken och sigma-bindningen mellan väten av H2 brytas snabbare. Med det har vi skapat två bindningsställen i alkenen och två fria väteatomer i reaktionsmediet.

Skapande av atombindnings- och separationsställen
Omedelbart därefter upptar varje fri väteatom sålunda ett av bindningsställena som bildas i alkenen. Eftersom det bildade ämnet endast har kol och väten, liksom endast enkla bindningar mellan kolerna, är det en alkan.
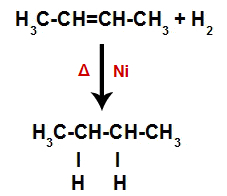
Ekvation som representerar alkanbildning vid hydreringen
B) Halogenering
En alken blandas med enkla ämnen (F2Cl2, br2 Hallå2) formad av halogener (klor, fluor, jod och brom) i en behållare och utsätts för påverkan av ljus (λ) och uppvärmning (Δ).

Allmänt schema för en halogeneringsreaktion i alkener
Verkan av ljus och uppvärmning gör att pi-bindningen av alken och sigma-bindningen mellan ämnen som bildas av halogen bryts snabbare. Med detta har vi skapat två bindningsställen i alkenen och två fria halogenatomer i reaktionsmediet.
Sluta inte nu... Det finns mer efter reklam;)

Skapande av atombindnings- och separationsställen
Omedelbart därefter upptar varje fri halogenatom således ett av bindningsställena som bildas i alkenet. Eftersom det bildade ämnet har halogen kopplat till en struktur som består av kol och väten är det ett organisk halogenid.

Ekvation som representerar organisk halidbildning vid halogenering
c) Hydrering
En alken blandas med vatten (H2O) i en behållare och utsattes för verkan av en katalysator (i detta fall svavelsyra).
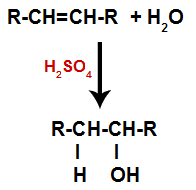
Allmänt schema för en hydratiseringsreaktion i alkener
Närvaron av svavelsyra i reaktionen gör att pi-bindningen av alken och sigma-bindningen mellan väte (H) och hydroxyl (OH) av vatten bryts snabbare. Med det har vi skapat två bindningsställen i alkenen och ett fritt väte och en hydroxyl i reaktionsmediet.
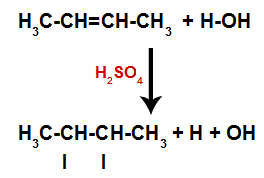
Skapande av atombindnings- och separationsställen
Kort därefter upptar sålunda väte och hydroxyl ett av bindningsställena som bildas i alkenen. Eftersom det bildade ämnet har hydroxylbundet till ett mättat kol (det gör bara enkla bindningar) är det en alkohol.
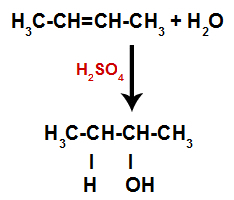
Ekvation som representerar bildandet av alkohol i hydrering
d) Tillsats med vätehalogenider
En alken blandas med en halogenerad oorganisk syra (HF, HI, HCl, HBr) i en behållare.

Allmänt schema för en syrahalogenidreaktion i alkener
Närvaron av syra i reaktionen gör att alenens pi-bindning bryts snabbare. Den enda bindningen i syran bryts eftersom dessa ämnen naturligt joniserar. Således skapas två bindningsställen i alkenen och det finns närvaron av ett fritt väte och en halogen i reaktionsmediet.
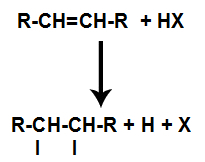
Skapande av atombindnings- och separationsställen
Kort därefter upptar sålunda väte och halogen ett av bindningsställena som bildas i alkenet. Eftersom det bildade ämnet har halogen kopplat till en struktur som består av kol och väten är det en organisk halid.
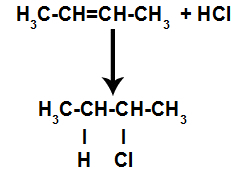
Ekvation som representerar organisk halidbildning vid halogenering
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Tilläggsreaktioner i Alkenes"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm. Åtkomst den 28 juni 2021.
Kemi

Alkaner, kolväten, metan, mättad kedja, alifatisk, paraffiner, bränslen, bensin, mineralvax, petroleum, oljeskiffer, naturgas, petrokemisk industri.
Kemi

Alkener, gas, eten, eten, plast, syntetiskt gummi, färgämnen, syntetiska tyger, sprängämnen, petroleumkrackning, polyeten, oljegas, olefiner, kolväten, kedja acyklisk koldioxid.
Alkyner, etiska kolväten, acetyleniska kolväten, acykliska kolkedjor, kolkedjor homogen, omättad kolkedja, trippelbindning, PVC, PVA, acetylen, syntetiskt gummi, plast, trådar textilier.


