Fram till 1824 trodde man att de byggda termiska maskinerna skulle kunna fungera perfekt, det vill säga man trodde att de kunde nå 100% avkastning, eller något i närheten av det värde. Med andra ord trodde forskare vid den tiden att de kunde använda all termisk energi levereras till dessa maskiner - det vill säga de trodde att de kunde förvandla all den energin till arbete.
Ingenjör Sadi Carnot var vid den tiden ansvarig för att göra demonstrationer där det var omöjligt att få 100% avkastning. Sadi föreslog att en ideal teoretisk termisk maskin skulle fungera genom en viss cykel, nu kallad Carnot-cykel.
I sin demonstration konceptualiserade Carnot två postulat, som föreslogs redan innan termodynamikens första lag lades fram. Se vad Carnots postulat säger:
Första postulatet av Carnot
- Ingen maskin som arbetar mellan två fasta temperaturer kan ge mer än Carnots idealiska maskin som arbetar mellan samma temperaturer.
Andra postulatet av Carnot
- Vid användning mellan två temperaturer, maskinen idealisk av Carnot har samma prestanda, oavsett driftvätska, och är helt reversibel, utan att lägga till energi.
Enligt de postulat som föreslagits av Carnot kan vi se garantin att effektiviteten hos en termisk motor är en funktion av temperaturerna i de varma och kalla källorna. Men genom att fastställa temperaturerna i dessa källor är Carnots teoretiska maskin den som lyckas ha högsta effektivitet.
Carnot-cykeln är en idealiserad, reversibel cykel, där driftsvätskan är en perfekt gas, vilket motsvarar två transformationer. isotermer det är två adiabatisk, varvas. Processerna som beskrivs av gasen i denna cykel är:
1.°) isotermisk expansion DA, under vilken gasen är i kontakt med TA-temperaturen (varm källa), som tar emot en kvantitet värme QA från den.
2.°) adiabatic expansion AB, under vilket det inte sker något värmeväxling med miljön. Systemet utför arbete med en minskning av den inre energin och därmed temperaturen.
3.°) BC isotermisk kontraktion, under vilken gasen är i kontakt med systemet med konstant temperatur TB (kall källa), vilket ger den en kvantitet värme QB.
4.°) adiabatisk sammandragnings-CD, under vilken gasen inte utbyter värme med miljön. Systemet får arbete, vilket tjänar till att öka sin inre energi och därmed dess temperatur.
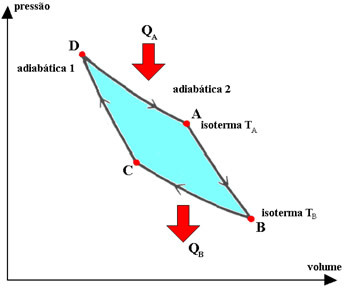
I Carnot-cykeln utbyttes värme (FDE och QB) och termodynamiska temperaturer (TDE och tB) av de varma och kalla källorna är proportionella, varvid förhållandet är:

Genom att ersätta effektivitetsekvationen för en termisk maskin får vi för Carnot-maskinen:
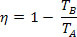
Med tanke på den kalla källans temperatur (TB) lika med noll kelvin (absolut noll) har vi η = 1 eller η = 100%. Detta motsäger emellertid den andra lagen om termodynamik, som garanterar att en inkomst av 100%, vilket får oss att dra slutsatsen att inget fysiskt system kan ha en temperatur som är lika med noll absolut.
Av Domitiano Marques
Examen i fysik
Källa: Brazil School - https://brasilescola.uol.com.br/fisica/maquinas-carnot.htm



