Saltsyra är en hydracid med hög joniseringspotential, det är en gulaktig vätska, mycket frätande och giftig. Den används i olika industriella processer, såsom tillverkning av rengöringsprodukter och farmaceutiska hydroklorider, i livsmedel och i ståltillverkningsprocesser.
Det finns också i den mänskliga organismen; O magsyra som verkar i matsmältningen av proteiner är en syralösning; saltsyra och andra ämnen, såsom enzymer och salter. Exponering, inandning eller intag av Koncentrerad saltsyra är mycket hälsoskadlig, som till och med kan orsaka dödsfall.
Läs också: Svavelsyra - ämne som har hög frätande effekt
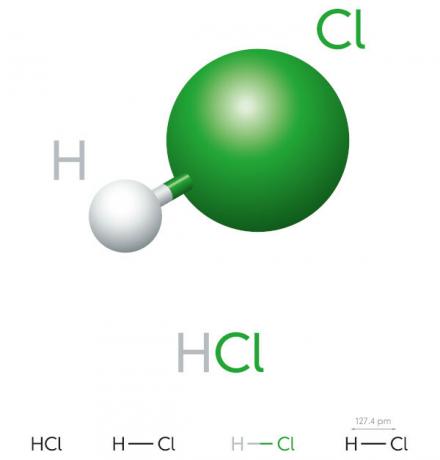
Saltsyraegenskaper
- oorganisk förening
- stark syra
- Hög joniseringspotential
- Flytande
- gulaktigt utseende
- Toxisk
- Frätande
- Flyktig
- Hygroskopisk (tenderar att absorberas ávatten av miljön)
- Lösligt i vatten
Sluta inte nu... Det finns mer efter reklam;)
Saltsyraproduktion
Saltsyran var upptäcktes av en muslimsk alkemist kallas Jabir Ibne Haiane, även känd som Gaber och anses vara far till arabisk kemi. Han syntetiserade ämnet baserat på a
reaktion mellan havssalt (NaCl) och svavelsyra (På2ENDAST4).2NaCl + H2ENDAST4 → I2ENDAST4 + 2HCl
För närvarande saltsyra produceras i stor skala genom elektroniskólys natriumklorid i vattenlösning. Från denna process erhålls gas klor (Cl2), gas väte (H2) och natriumhydroxid (NaOH). Klor- och vätgaser reagerar för att bilda saltsyra:
Cl2 + H2 → 2HCl
I alla fall, denna reaktion är extremt exotermisk och mycket farligt. För närvarande är det mesta av den saltsyra som produceras industriellt associerat med produktionen av organiska föreningar, vilket är en mer ekonomisk och säkrare process.
R-H + Cl2 → R-Cl + HCl
(Betrakta R som en organisk radikal.)
Se också: Tips för att bestämma-om syranas styrka

Saltsyraapplikation
- Betning av metall: Saltsyra används för att "rengöra" metaller innan de bearbetas, vilket avlägsnar rost, fjäll och andra föroreningar från deras yta.
- Produktion av organiska föreningar: saltsyra används som ett reagens för att erhålla vinylklorid, som används vid tillverkning av plast. Saltsyra kommer också från kloropren, som används i syntetiska gummi.
- Produktion av oorganiska föreningar: saltsyra finns i flera industriella processer för tillverkning av reagens och föreningar oorganiska ämnen, bland annat produkter för vattenbehandling, såsom järn (III) klorid och aluminium.
- Används som rengöringsprodukt: Saltsyra används också för rengöring av verktyg och maskiner efter konstruktion, hushålls- och kemisk rengöring.
- Livsmedelsbearbetning: Saltsyra används i olika reaktioner för produktion av livsmedel och tillsatser, såsom hydrolys av stärkelse och proteiner, eller i slutprodukten för pH-balans.
- Läkemedelsproduktion: Saltsyra används vid framställning av lösliga saltsyror närvarande i flera läkemedel, såsom doxycyklinhydroklorid, som används vid behandling av tyfus feber och smittkoppor.
Saltsyra i kroppen
Saltsyra finns i vårt matsmältningssystemet, magsaften som produceras av magen är en lösning av vatten, enzymer, saltsyra, oorganiska salter och en liten andel mjölksyra.
O matkaka förvandlas till chyme, en sur massa (tack vare magsaftens verkan och dess sura sammansättning), detta är när matsmältning av proteiner, transformerad till polypeptider och aminosyror som kommer att absorberas av kroppen.
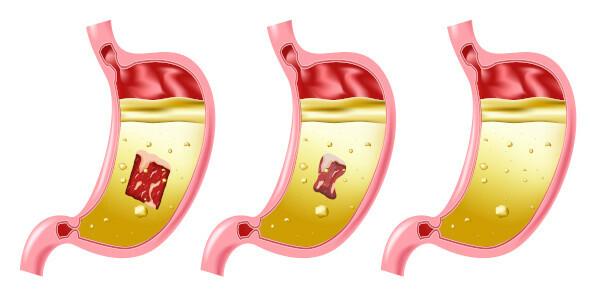
Saltsyrorisker
Saltsyra är en mycket stark och frätande syra, så kontakt med ämnet orsakar flera skador:
- Hud: Orsakar brännskador och irritation.
- Ögon: Orsakar allvarlig irritation och kan orsaka blindhet.
- Inandning: Orsakar irritation och skador på de övre luftvägarna.
- intag: orsakar korrosion i hela munsystemet och i mag-tarmkanalen kan det orsaka kräkningar, blödningar, diarré, cirkulationsproblem, vilket kan leda till döden.
- Exponeringfortsättning följer: attackerar slemhinnorna först och orsakar dermatit och konjunktivit, blödande tandkött, fotosensibilisering; frekvent inandning, även i låg koncentration av föreningen, kan orsaka gastrit och näsblod.
Också tillgång: Ättiksyra egenskaper och egenskaper

lösta övningar
Fråga 1 - (Udesc) När det gäller saltsyra kan det konstateras att:
A) när den är i vattenlösning tillåter den elektrisk ström.
B) är en disyra.
C) är en svag syra.
D) har en låg grad av jonisering.
E) är en jonisk substans.
Upplösning
Alternativ A. Saltsyra är inte en disyra eftersom den bara har en joniserbar H utan en stark syra, molekylärt ämne med hög joniseringspotential. DE jonisering i ett vattenhaltigt medium främjar ledningen av elektrisk ström på grund av förekomsten av fria joner.
Fråga 2 - I en lösning av saltsyra och vatten kan vi säga att förekomsten av molekylär klorväte (HCl) är minimal, detta beror på att
A) saltsyra i kontakt med vatten späds ut.
B) väteklorid är ett ämne som inte solubiliseras i vatten.
C) väteklorid har en hög joniseringspotential, därför bildar HCl-molekylen H-joner i ett vattenhaltigt medium+ Cl-.
D) Saltsyran, som är mycket flyktig, skiljer sig från lösningen och lämnar endast vattenmolekyler.
E) saltsyra är en jonisk substans, därför dissocieras den i en vattenlösning och bildar joner.
Upplösning
Alternativ C.
A) Svaret stämmer inte med frågan, utspädning av saltsyra i vatten motiverar inte frånvaron av molekylär HCl.
B) Felaktigt, väteklorid är lösligt och har en affinitet för vatten.
C) Korrekt
D) Även om saltsyra är flyktig, sker denna segregering av de två arterna i lösningen inte signifikant.
E) Saltsyra är en lösning av klorväte och vatten, där klorväte är en icke-jonisk molekylär substans.
Av Laysa Bernardes Marques de Araujo
Kemilärare
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
ARAúJO, Laysa Bernardes Marques de. "Saltsyra"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Åtkomst den 27 juni 2021.


