DE batteri är ett system där oxidations-reduktionsreaktionen äger rum. I denna enhet omvandlas den kemiska energin som produceras i den spontana reaktionen till elektrisk energi.
Oxidations- och reduktionsreaktioner sker samtidigt i en cell. När en art genomgår oxidation donerar den elektroner till den andra arten, som, när den tar emot dem, genomgår reduktion.
Därför är den som genomgår oxidation reduktionsmedlet och den som genomgår reduktion är oxidationsmedlet.
DE oxidation uppstår när en art förlorar elektroner och blir en katjon: A → A+ + och-.
DE minskning inträffar när en art får elektroner och blir elektriskt neutral: B+ + och- → B.
I de kemiska ekvationerna, detta elektronöverföring visas av förändringen i oxidationstalet (nox).
Reduktionsreaktioner sker inuti cellerna och den elektriska strömmen uppstår vid migration av elektroner från den negativa till den positiva polen.

Hur fungerar en stack?
Ett redoxreaktion kan generellt representeras av ekvationen:
A + B+ → A+ + B
Var,
A: ämne som oxideras, förlorar elektroner, ökar sitt värde och är reduktionsmedlet.
B: ämne som genomgår reduktion, får elektroner, minskar oxidation och är oxidationsmedlet.
Se i följande bild hur denna process kan representeras.
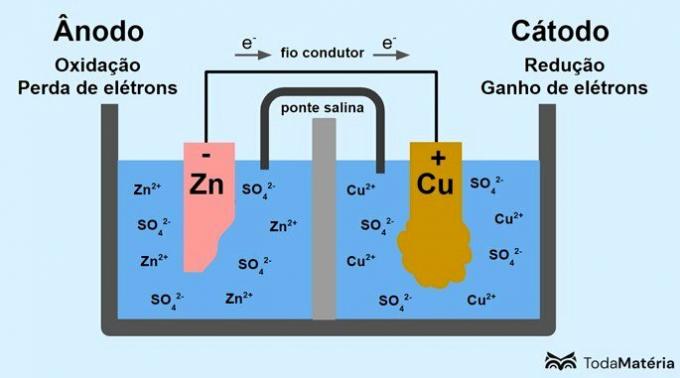
Systemet uppdelat i två halvceller och bildat av två metalliska elektroder anslutna externt med en ledande tråd utvecklades av John Frederic Daniell (1790-1845) 1836.
Batteriet består av två elektroder, förbundna med en ledande tråd, och en elektrolyt, där jonerna finns. Elektroden är den fasta ledande ytan som tillåter utbyte av elektroner.
anod: elektrod vid vilken oxidation sker. Det är också batteriets negativa pol.
Katod: elektrod vid vilken reduktion sker. Det är också batteriets positiva pol.
På bilden ovan är metallisk zink anoden och genomgår oxidation. Metallisk koppar är katoden och genomgår reduktion. Migrationen av elektroner (e-) sker från anoden till katoden genom den ledande tråden.
Reaktionerna som uppstår i bildsystemet är:
- anod (oxidation): Zn(s) → Zn2(här) + 2e-
- Katod (reduktion): Cu2+(här) + 2e- → ass(s)
- allmän ekvation: Zn(s) + asså2+(här) → ass(s) + Zn2+(här)
Zink är en metall med en större tendens att förlora elektroner och därför bildas katjoner i lösningen. Zinkelektroden börjar slitas ut och förlorar massa eftersom zink släpps ut i lösning när Zn-katjoner bildas2+.
Elektronerna från anoden anländer till katoden och metallkatjonerna omvandlas vid mottagandet till metallisk koppar, som avsätts på elektroden och ökar dess massa.
Saltbryggan är en jonström som ansvarar för cirkulationen av joner i systemet för att hålla det elektriskt neutralt.
Läs även om oxidationstal (nox).
batterityper
I en cell bestäms tendensen hos kemiska arter att ta emot eller donera elektroner av reduktionspotentialen.
Komponenten med den högsta reduktionspotentialen tenderar att genomgå reduktion, det vill säga att få elektroner. Arten med den lägsta reduktionspotentialen och följaktligen den högsta oxidationspotentialen tenderar att överföra elektroner.
Till exempel, i redoxreaktionen Zn0(s) + asså2+(här) → ass0(s) + Zn2+(här)
Zink oxiderar och donerar elektroner eftersom det har en reduktionspotential E0 = -0,76V, mindre än reduktionspotentialen för koppar E0 = +0,34V och därför tar den emot elektroner och genomgår reduktion.
Se nedan för andra exempel på stackar.
Zink- och vätestapel
Oxidationshalvreaktion: Zn(s) → Zn2+ + 2e- (OCH0 = -0,76V)
Reduktionshalvreaktion: 2H+(här) + 2e- → H2(g) (OCH0 =0,00V)
Global ekvation: Zn(s) + 2H+(här) → Zn2+(här) + H2(g)
Stackrepresentation:
Koppar och vätecell
Oxidationshalvreaktion: H2(g) → 2H+(här) + 2e- (OCH0 = 0,00V)
Reduktionshalvreaktion: Cu2+(här) + 2e- → ass(s) (OCH0 = +0,34V)
Global ekvation: Cu2+(här) + H2(g) → 2H+(här) + asså(s)
Stackrepresentation:
Få mer kunskap om ämnet med innehållet:
- elektrokemi
- Elektrolys
Bibliografiska referenser
FONSECA, M. R. M. Kemi, 2. 1. ed. São Paulo: Attika, 2013.
SANTOS, W.L.P; MOL, G.S. Medborgarkemi, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Anslut kemi, 2: kemi. - 2. ed. São Paulo: Saraiva, 2014.



