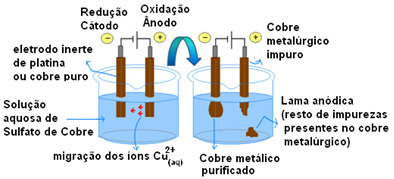
ТХЕ слани мост је предложио енглески хемичар Фредериц Даниелл, 1836. године, када је овај учењак основао батерија по њему названа (Данилова гомила). овај мост је цев у облику слова У која има два порозна краја. (састоји се од памука или агар-агара) и садржи водени раствор формиран од воде и соли. Индиректно повезује решења две полућелије ћелије (аноде и катоде).
Посматрање: Анода је негативни пол батерије и ту се дешава оксидација, а катода је позитивни пол и тамо где долази до редукције.
Да би се разумела важност сланог моста, у почетку је неопходно разумети функционисање гомиле. Погледајте доњи дијаграм:
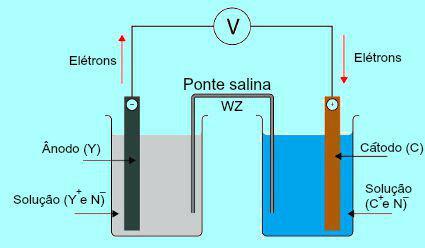
Општа шема Даниелл стека
У почетку се метал (И) плоче присутне у аноди подвргава оксидацији. Током оксидације, метал прелази у катион, који пада у раствор у коме се налази плоча. Из тог разлога, раствор аноде почиње да представља већу концентрацију катиона (И+). У овом случају се примећује смањење металне плоче аноде.
И → и- + И+
Затим, електрони изгубљени током оксидације метала анодне плоче путују кроз спољну електричну жицу и одлазе до металне плоче присутне у катоди. Тако се плоча присутна на катоди пуни електронима.
-
Садашњи катиони (Ц.+) у раствору се крећу према катодној плочи јер је напуњена електронима. Катиони, при добијању електрона присутних у плочи, постају неутрални (стабилни и чврсти) и приањају уз њу. Из тог разлога, раствор катоде представља већу концентрацију аниона него катјона. У овом случају се примећује повећање величине катодне металне плоче.
Не заустављај се сада... После оглашавања има још;)
Ц+ + и- → Ц.
Из разумевања како Данијелова гомила, могуће је уочити да раствор присутан у аноди прима већу количину И катиона+ услед оксидације метала Кс плоче. Раствор присутан у катоди, с друге стране, губи своје катионе (Ц.+) јер пате од смањења плака.
Управо по овом питању је истакнут рад сланог моста. Главна функција овог моста је да промовише равнотежу наелектрисања присутних и у анодним и у катодним решењима. У солном мосту увек имамо сол (обично калијум-хлорид или амонијум-нитрат.) Раздвојену у води. Погледајте приказ једначине у мосту соли:
ВЗ + Х2О → В+ + З-
У мосту са соли налазе се два јона (В+ и З.-), који се померају на катоду и аноду према:
Тхе) Анода прима анионе (З-) присутан у солном мосту због оксидације елемента (И), што узрокује повећање количине катиона (И+) у решењу.
Б) Катода прима катионе (В+) солног моста, јер је током рада на батерији катион (Ц+) присутан у решењу је смањен на табли. Дакле, раствор катоде има већу количину аниона (Н-) и зато прима катион присутан у мосту соли.
Ја сам, Диого Лопес Диас
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ДАНИ, Диого Лопес. „Једрински мост“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Приступљено 28. јуна 2021.