Према првом закону термодинамике, у било ком термодинамичком процесу количина топлоте К примљен од система једнак је раду који је обавио плус варијацији његове унутрашње енергије.
Када је притисак константан, топлота коју систем размењује са спољним медијем користи се за рад и за промену унутрашње енергије. У многим практичним ситуацијама системи су подвргнути атмосферском притиску, као у случају хемијске реакције. Горња слика приказује ПВ дијаграм ове врсте процеса.
У овом случају, у једначини Првог закона,
К = τ + ∆У
ниједан од појмова није нула. Дело је написано као функција промене запремине запреминеВ, као што су:
τ = П.∆В
За одређени случај идеалног моноатомског гаса, енергија се може записати на следећи начин:

Према томе, Први закон термодинамике можемо написати у функцији ΔВ:


Размењена топлота са медијумом је (5/2) П.ΔВ, а 40% од укупног броја - што одговара П.ΔВ - користи се за извођење радова; и (3/2) П.ΔВ, што одговара 60% од укупног броја, користе се за промену унутрашње енергије. Овај резултат важи за идеалан моноатомски гас.
Топлота је повезана са променом температуре (користећи закон идеалног гаса) тако што:
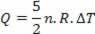
Тако се испоручена топлота може израчунати променом температуре или променом запремине.
Аутор Домитиано Маркуес
Дипломирао физику
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm

