Идеје о грађи материје (атома) појавиле су се у древној Грчкој, око 450. п. а., углавном из Демокрита и Леуципа. Међутим, атом је заправо научни карактер добио тек након тзв Далтонова атомска теорија.
ТХЕ Далтонова атомска теорија био је основни за развој атомског знања, јер је другим научницима служио као основа за познавање атома и његових карактеристика.
Ко је био Јохн Далтон?
Јохн Далтон, хемичар по струци, рођен је у Цумбрији у Енглеској 1766. године и умро у Манцхестеру 1844. године. Од малена је његов живот био предодређен за научна истраживања и подучавање, толико да је предавао или доприносио развоју различитих области знања.
Његово највеће наслеђе научника, међутим, био је развој прве атомске теорије. Кроз неколико експеримената повезаних са мешавином гасова и познавањем дела која је предложио Лавоисиер, Далтонова атомска теорија појавила се 1808. године.
Постулати Далтонове атомске теорије
Далтонова атомска теорија заснивала се на експериментима, али ниједан од ових експеримената није могао јасно открити атом. Отуда је Далтон атом назвао најмањим делом материје.
Далтонова теорија износи много више постулата него доказа. Погледајте неке од њих:
Атоми су масивног и сферног облика (слични билијарској кугли);
Атоми су недељиви;
Атоми су неуништиви;
Једно хемијски елемент то је скуп атома истих својстава (величине и масе);
Атоми различитих хемијских елемената имају различита својства једни од других;
Релативна тежина два атома може се користити за њихово разликовање;
Сложена хемикалија настаје истом комбинацијом различитих врста атома;
Комбиновањем различитих атома настају различите хемијске супстанце.
Прикази Далтоновог атомског модела
Далтон је свом атомском моделу дао име билијарска кугла и, према томе, почео је да представља сферне симболе атоме елемената познатих у његово време.
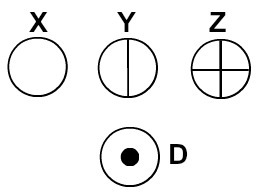
Атоми представљени према Далтоновој атомској теорији
Свака атомска представа која има одређени детаљ указује на другачији хемијски елемент. Књиге и вежбе основног и средњег нивоа дидактички представљају атоме само сферама различитих боја.
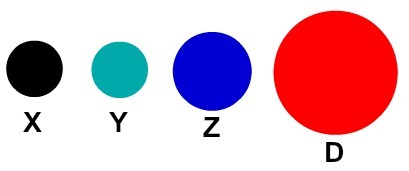
Дидактички приказ атома
Прилози Далтонове атомске теорије
разумевање Лавоисиеров закон очувања масе
Француски хемичар Лавоазије тврдио је 1785. да је „У хемијској реакцији се маса чува јер нема ни стварања ни уништавања атома ”. Далтонова атомска теорија доказала је ову чињеницу, јер један од његових постулата каже да је атом неуништив.
Стога, ако изгарање угља (Ц) спроводимо у присуству гаса кисеоника (О2), имаћемо хемијску реакцију између једног атома угљеника и два атома кисеоника. Ова реакција ће створити угљен-диоксид (ЦО2), који има потпуно исте атоме који су творили супстанце пре реакције.
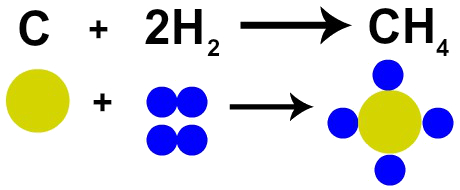
Представљање Лавоисиеровог закона Далтоновим атомским моделом
разумевање једноставне супстанце
Помоћу Далтонов атомски модел, можемо разумети једноставну супстанцу, односно ону која има атоме исте карактеристике формирајући молекул. Према томе, имамо атоме који припадају истом хемијском елементу.
У супстанци Ф.2, на пример, имамо два атома флуора, па морамо да користимо две врсте једнаких атома у представљању према Далтоновој атомској теорији.

Једноставно представљање супстанце према Далтонов атомски модел
разумевање сложене супстанце
У сложеној супстанци имамо атоме различитих карактеристика који чине молекул. Стога имамо различите хемијске елементе који творе супстанцу.
Супстанца Х.2О, на пример, има три атома: два водоника и један кисеоник. Погледајте његову представу према атомском моделу Далтона:
Приказ једињења једињења према кожиДалтонов атомски модел
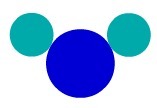
Разумевање смеша
Разумевање смеше (удруживање две или више различитих супстанци) кроз Далтонову атомску теорију је једноставно: само ставите два различита молекула у исти контејнер.

Приказ друге смеше Далтонов атомски модел
Други научни прилози Џона Далтона
увео концепт атомска маса;
Формулирао закон парцијалних притисака гасова (Далтонов закон);
Открио оштећење вида тзв далтонизам;
Проучавао понашање пара и гасова на различитим температурама;
Открио је да се сви гасови шире на исти начин (покушавају да заузму одређено место) у свемиру.
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm
