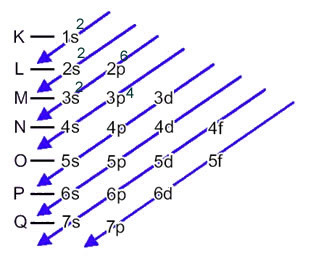
Електронска расподела електрона атома у неутралном или основном стању обично се изводи са Паулингов дијаграм, приказано испод:
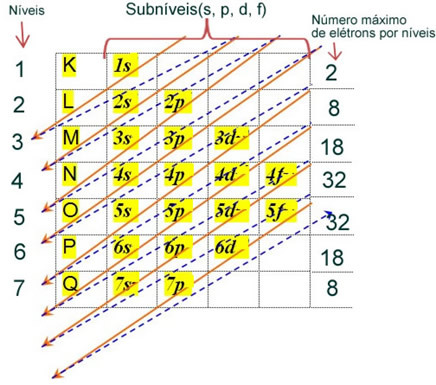
Детаљна правила ове дистрибуције могу се наћи у следећа два текста на нашој веб страници: „Електронска дистрибуција електрона" и "Правила електронске дистрибуције”.
Електронска дистрибуција јона у почетку делује на исти начин као и за атоме у неутралном стању; са само једном разликом. Пошто је јон атом који је стекао или изгубио електроне, морамо то узети у обзир и урадити следеће:

Важно запажање је: промена се врши на најудаљенијем нивоу и није најенергичнија.
ако је јон а катион, морамо уклонити електроне да је изгубио. Погледајмо пример:
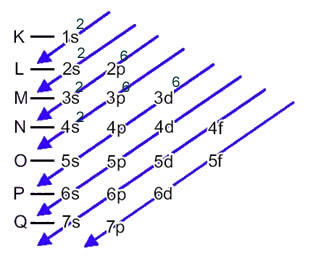
Атом гвожђа (атомски број = 26) има следећу електронску расподелу у поднивоима у енергетском редоследу: 1с2 2с2 2п6 3с2 3п6 4с2 3д6. Што се тиче електронских слојева, имамо: К =2; Л = 8; М = 14; Н = 2.
Ова дистрибуција је приказана на Паулинг дијаграму испод:
Када атом гвожђа изгуби 2 електрона, он се претвара у катион Фе.2+. Дакле, приликом прављења ваше електронске дистрибуције морамо
уклонити 2 електрона из последње љуске(Н) а не са најенергичнијег нивоа, како је приказано испод: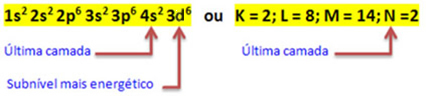
Дакле, електронска дистрибуција Фе катион2+ даје:
1с2 2с2 2п6 3с2 3п6 3д6 или К = 2; Л = 8; М = 14
Сада, ако морамо да извршимо електронску дистрибуцију а анион, морамо додати електроне које је примио.Погледајте како се то ради у следећем примеру:
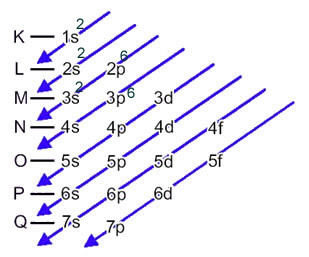
Сумпорни анион (16с2-) настаје од атома сумпора (16С) појачањем 2 електрона, како је назначено наелектрисањем 2-. Његова основна електронска дистрибуција дата је:
1с2 2с2 2п6 3с2 3п4 или К = 2; Л = 8; М = 6
У овом случају, последњи подниво је исти као и ниво енергије 3п. Дакле, томе додамо два електрона сумпорног аниона:
1с2 2с2 2п6 3с2 3п6 или К = 2; Л = 8; М = 8
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm
