Гасниидеално је онај где судара између честица су савршено еластичне. Између његових честица не постоји никаква интеракција, на пример снаге привлачне или одбојне, штавише, ове честице не заузимају простор.
Према кинетичка теорија гасова, термодинамичко стање идеалног гаса је у потпуности описано променљивим од притиска, обим и температура.
Гледајтакође: Калориметрија: мапа ума, формуле и решене вежбе
концепт идеалног гаса
Идеални гасови састоје се искључиво од честицеудимензијетачно (занемарљиве величине) који су у кретањехаотичан је укључено високобрзина. Код ове врсте гаса температура и брзина транслације честица су пропорционалне.
С обзиром да не постоји интеракција између честица идеалног гаса, унутрашња енергија овог гаса увек је једнак збиру од кинетичке енергије свих честица које га чине.
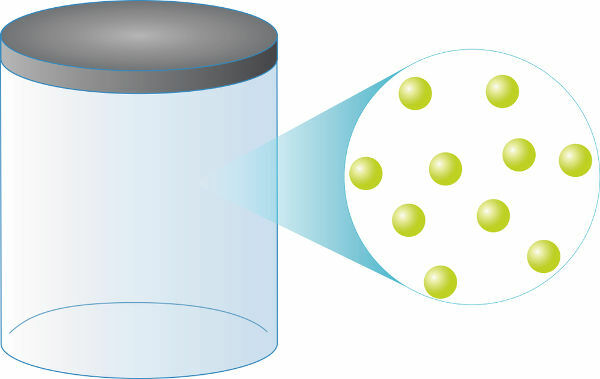
Какви год да су идеални гасови, увек ће имати исте бројучестице за исту запремину. Њихова маса ће, пак, директно зависити од вашег
моларна маса (мерено у г / мол), поред тога, 1 мол идеалног гаса (око 6.0.1023 честице) ће увек заузимати а запремина једнака 22,4 л.ти гасовиправи, где постоји појава сударанееластична између честица, врло се приближавају понашању идеалних гасова у режими ниског притиска и високе температуре. Случајно је, под нормалним условима притиска и температуре на Земљи (25 ° Ц и 1 атм), већина гасови се понашају као идеални гасови, а то олакшава израчунавање предвиђања о термодинамичком понашању њихов.
Неки гасови, попут водена пара, који је разблажен у атмосферски гас, не могу се сматрати идеалним гасовима, али да гасовиправи. Ови гасови имају значајне интеракције између својих честица, што може сажети, узрокујући их течни, ако га има пад температуре.
Карактеристике идеалних гасова
Погледајте на апстрактан, неке карактеристике идеалних гасова:
- У њима се дешавају само савршено еластични судари између честица;
- У њима нема интеракција између честица;
- У њима честице имају занемариве димензије;
- 1 мол идеалног гаса заузима запремину од 22,4 л, без обзира на то који је гас;
- Стварни гасови се понашају као идеални гасови када су под режимима ниског притиска и високе температуре;
- Већина гасова понаша се слично идеалним гасовима.
закон о идеалном гасу
Проучавање гасова које су развили научници Цхарлесбоиле,ЈосифаЛоуисгеј-лусак и Робертбоиле довело до појаве три емпиријска закона, користи се за објашњавање понашања идеалних гасова у режимима температура, притиска и запреминуконстанте, редом.
Ови закони су заједно чинили неопходну основу за настанак закон о идеалном гасу, који се односи на почетно термодинамичко стање гаса, дефинисане величинама П.1, Т1 и В.1, Са својим коначно термодинамичко стање (П.2, В.2 и т2), након што је претрпео неке трансформација гаса.
Погледајте формула општег закона о гасу:
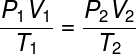
Општи закон о гасу каже да производа даје притиска крзно запреминуодгасни, подељено термодинамичком температуром, у келвинима, једнако је константи. Ову константу, пак, описује клапеирон једначина, гледати:
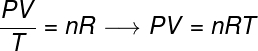
не - број молова (мол)
Р. - универзална константа савршених гасова (0,082 атм.л / мол. К или 8,31 Ј / мол. К)
У формули, П. је притисак који врши гас, В. је запремина коју заузима овај гас, и Т. је температура измерена у келвинима. величина не односи се на број мадежа, док Р. је универзална константа идеалних гасова, која се често мери у јединицама атм.л / мол. К или у Ј / мол. К, последњег усваја СИ.
Гледајтакође:Шта је соларни ветар и како утиче на Земљину атмосферу?
Унутрашња енергија идеалног гаса
ТХЕ енергијеунутрашње идеалних гасова може се израчунати помоћу производа између константануБолтзманн и термодинамичку температуру, имајте на уму:
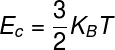
К.Б. - Болтзманнова константа (К.Б. = 1,38.10-23 Ј / К)
Из претходног односа, који нам омогућава да израчунамо просечна кинетичка енергија из честица идеалног гаса извлачимо следећу формулу која се може користити за израчунавање колика је средња квадратна брзина молекула идеалног гаса, за дату температуру Т, имајте на уму:
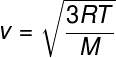
М. - моларна маса (г / мол)
Ова формула вам омогућава да видите да а додатакутемпература идеалног гаса резултира повећањем средње квадратне брзине честица.
Знате више:Откријте од чега је светлост направљена и које су њене карактеристике
Решене вежбе на идеалним гасовима
Питање 1) Два мола идеалног гаса и под притиском од 1 атм налазе се на температури од 227 ° Ц. Израчунајте у литрима запремину коју заузима овај гас.
Подаци: Р = 0,082 атм.л / мол. К.
а) 75 л
б) 82 л
в) 15 л
г) 27 л
д) 25 л
Шаблон: Слово Б.
Резолуција:
За израчунавање запремине овог гаса користићемо Цлапеиронову једначину, међутим, пре него што извршимо прорачун, потребно је температуру од 227 ° Ц трансформисати у келвин. За ово овој температури додамо фактор 273, што резултира температуром од 500 К.
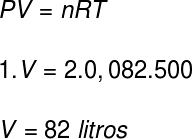
Према резолуцији, запремина коју заузима гас је 82 литра.
Питање 2) Идеалан гас заузима запремину од 20 л, када је подвргнут притиску од 3 атм, тако да његова температура остаје константна, а запремина утростручена. Израчунајте коначни притисак овог гаса након што је прошао ову трансформацију.
а) 1 атм
б) 3 атм
в) 5 атм
г) 8 атм
д) 9 атм
Шаблон: Слово а
Резолуција:
Да бисмо решили ову вежбу, послужићемо се општим законом гасова, имајте на уму:
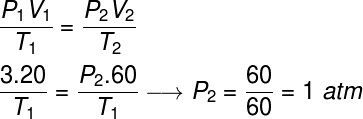
Да би се извршио прорачун, било је потребно гасу доделити запремину од 60 л, пошто се његова запремина утростручила током трансформације.
Аутор Рафаел Хеллерброцк
Наставник физике


