У тексту "Наслов или масни проценат”Видели смо како израчунати однос између масе растворене супстанце и масе раствора за чврсте, течне и гасовите растворе. У овом тексту ћемо, међутим, видети да је могуће израчунати и титар у смислу запремине за растворе са течним или гасовитим компонентама.

Наслов у обиму може се израчунати изразом:
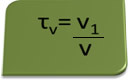
Размотримо као пример водени раствор етилног алкохола који се користи као антисептик и дезинфицијенс, а који је припремљен додавањем 70 мл чистог алкохола у довољно воде да се доведе до запремине од 100 мл решење. Тако имамо:
τ = 70 мл = 0,7
100мл
Наслов можемо изразити и у процентима, само помноживши резултат са 100%. У овом случају имамо 70% раствор етилног алкохола, што значи да од сваких 100 запреминских јединица раствора 70 запреминских јединица чине алкохол.
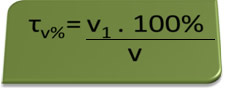
У доњем случају имамо 70% раствор етилног алкохола у запремини раствора од 250 мл; што значи да је 175 мл алкохола, према прорачунима:
100 мл 70 мл алкохола
250 мл к
к = 70. 250
100
Кс = 175 мл алкохола

Међутим, не можемо рећи да у овом случају имамо 75 мл (250-175) воде. За разлику од масног титра, у којем масу растварача можемо додати маси растварача да бисмо пронашли масу раствора, то се не може учинити у односу на запремински титар.

То значи да запремина раствора није једнака збиру запремине растварача и раствора растворене супстанце (мада се често разлика може сматрати занемарљивом). То је зато што интермолекуларне силе које постоје у овим течностима утичу на коначни волумен.
У случају поменутог раствора, етилног алкохола, на пример, када мешамо алкохол са водом, долази до контракције укупне запремине раствора; односно коначна запремина ће бити мања него ако бисмо додали запремину само алкохола и воде. То је зато што молекули алкохола успостављају везе или везе водоника са молекулима воде, смањујући размаке између њих.
Због тога се у овом и другим случајевима запремина раствора мора мерити експериментално када није предвиђена у вежби.
Запремински проценат се широко користи у случајевима алкохолних пића и комерцијалног алкохола, као што је горе поменуто. Погледајте две важне примене овог прорачуна:
- Алкотест: алкотест мери концентрацију етилног алкохола у крви, а у Бразилу је забрањено да било ко вози било коју врсту возила са садржајем алкохола у крви једнаким или већим од 0,1% запремине. Особа са овим садржајем алкохола има за сваки литар крви 1 мл алкохола, као што показују следећи прорачуни:
τв%=В.1. 100%
в
0,1 % = В.1. 100%
1Л
В.1 = 0,1% → В1 = 0,001 Л = 1 мл
100%

- Садржај етанола у бензину: у Бразилу се бензин регулише додавањем етанола. Али садржај етанола у бензину мора бити највише 24 вол.% Анхидрованог алкохола (јер бензин мора бити без воде). Што се више бензина додаје етанолу, боја горива постаје све светлија, а густина се повећава.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm

