Тоноскопија је заједничко власништво која проучава снижавање максимални притисак паре датог растварача услед растварања нехлапне (молекуларне или јонске) растворене супстанце. Остала колигативна својства су:
Ебулиосцопи
криоскопија
осмоскопија
Из горе наведене дефиниције је видљиво да се заиста разуме шта је тоноскопија, Неопходно је знати још три концепта:
То је сила коју врши пара одређене течности на зидовима затвореног контејнера када је брзина испаравања једнака брзини кондензације.
У посуди са одређеном количином етанола, који испарава под утицајем температуре околине, пошто пара наилази на зидове посуде, завршава у течност. Временом брзина испаравања постаје једнака брзини кондензације. У овом тренутку сила коју пара врши на зидове посуда назива се максимални притисак паре.
Ментална мапа: тонометрија или тоноскопија

* Да бисте преузели мапу ума у ПДФ-у, Кликните овде!
Распуштање
То је способност растварача да раствори одређену растворену супстанцу. Након растварања, растворени раствор и растварач почињу да успостављају међусобну молекуларну интеракцију, односно међусобно су повезани.
нехлапна растворена супстанца
То је материјал који има високу тачку кључања, то јест не може се претворити у гас на собној температури, на пример. Тако, када се дода растварачу, неће доћи до губитка овог материјала у животној средини у облику гаса.
О. нехлапна молекуларна растворена супстанца је онај који није у стању да се подвргне јонизацији или дисоцијацији када се раствори у растварачу. Дакле, ако у растварач додамо молекул ове растворене супстанце, то ће бити само у средини.
тијонски неиспарљиви олут é који пати од феномена дисоцијација или јонизација, односно у њему долази до прекида веза између атома, што узрокује појаву фракционисање молекуларне јединице. Ако растворимо 1 мол сумпорне киселине (Х.2САМО4) у води, на пример, имаћемо присуство два мола хидронијевог катиона и један мол сулфатног аниона у средини, као што је приказано у једначини испод:
Х.2САМО4 + 2Х2О → 2Х+ + ОС4-2
Разјашњавањем ових основних појмова постаје лакше и јасније разумевање тоноскопије.
Разумевање тоноскопије
Да бисмо разумели тоноскопију, проучимо укратко понашање течности као што су вода и етанол. Тачке кључања ова два растварача су 100О.Ц и 78О.Ц. Због тога етанол испарава брже од воде када су на истој температури и у истој количини.
Ако се у једној посуди налази 50 мл етанола, а у другој 50 мл воде, на пример, затворене и 250О.Ц, максимални притисак паре у посуди за етанол биће већи јер је унутрашња количина паре већа.
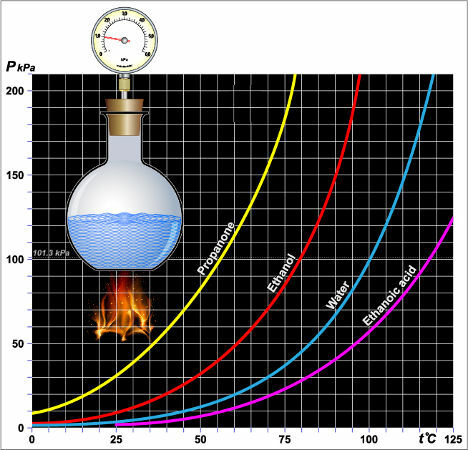
графички гледано, кад год је крива течности удаљенија од и (вертикалне) осе, нижи ће бити њен максимални притисак паре, као на доњем графикону:

Притисак паре различитих течности
Графички титл: Пропаноне = пропанон (ацетон)
Етанол = етанол
воде = вода
Етанска киселина = Етанска киселина
На графикону, можемо потврдити да притисак паре етанола (црвена кривина) је увек већа од воде (плава кривина) на било којој температури.
БЕЛЕШКА: Укратко, што је виша тачка кључања датог растварача, то је нижи његов максимални притисак паре и обрнуто.
Као тоноскопија проучава смањење максималног притиска паре услед растварања нехлапне растворене супстанце у растварачу, ако у води помешамо натријум хлорид (НаЦл), максимални притисак водене паре, на 100О.Ц, који износи 760 ммХг, дефинитивно ће се смањити. Али зашто се то догађа?
Када се натријум хлорид (јонска растворена супстанца) раствори у води, његови јони ступају у интеракцију са молекулима воде. Ова интеракција отежава испаравање растварача. Како је испаравање отежано, у посуди ће бити мање водене паре, што ће довести до смањења максималног притиска паре.
Тако, што је већа количина натријум хлорида у истој количини воде, то ће теже бити испаравање и нижи максимални притисак паре.
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-tonoscopia.htm