У ковалентне везе, такође зван молекуларне или хомополарне везе, су они који се јављају између атома електронегативни елементи, односно са тенденцијом да примају електроне успостављајући везу од делећи електроне из њихових валентних љуски.
Ковалентно везивање може настати између следећих елемената: водоник, неметали и полу метали. Метали никада не учествују у овој врсти лепљења.
Размотримо једноставан пример ковалентне везе: водоник-везујућа веза (Х2):
Х + Х → Х2
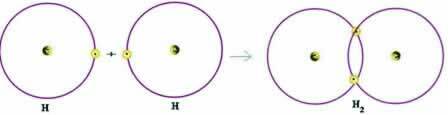
Имајте на уму да су оба атома требала да приме електрон да би употпунили своју валентну љуску - према Октетском правилу - и, на тај начин, да би остали стабилни. Стога су делили своје електроне и, на тај начин, обојица су имали два електрона, имали су комплетну К-љуску и стекли конфигурацију племенитог гаса хелијума.
Ово дељење електрона је оно што разликује ову врсту везе од јонске везе, у којој се одвија пренос електрона.
Погледајте доњу слику за још два примера овог случаја:
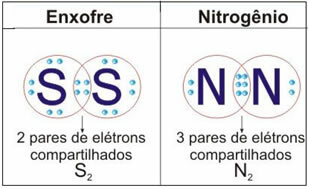
У овој врсти везе долази до стварања молекула који се могу представити њиховим одговарајућим
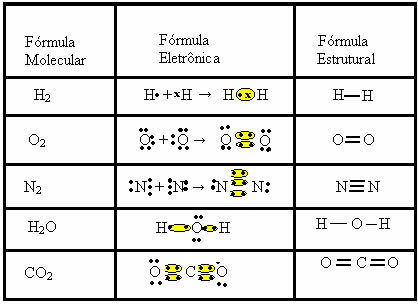
молекуларне формуле, односно најједноставнији приказ који указује на то колико атома сваког елемента има у молекулу. Неки примери молекуларних формула су: Х.2, С.2, О.2, не2, Х2О, ЦО2итд.Ковалентна веза се може представити са две друге формуле:
- Електронска формула или Луисова формула: у овој формули се такође појављују електрони валентне љуске сваког атома и формирање електронских парова. Ови електрони су симболизовани знаковима . или к;
- Равна структурна формула или Цоупер структурна формула: приказује везе елемената, при чему сваки заједнички пар одговара цртици. Ако је то само цртица, називамо је једном везом; ако су две, двострука веза; а ако постоје три цртице, трострука веза.
Погледајте друге примере ковалентних веза које су представљене са ове три хемијске формуле:
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm
