Раствор је хомогена смеша две или више супстанци.. Као, на пример, раствор соли (растворене супстанце) растворен у води (растварач).

Овај поступак је веома важан у хемијским лабораторијама и индустрији, јер хемичар треба да припреми растворе са познатим концентрацијама. Даље, у експерименталним активностима користе се раствори са врло ниским концентрацијама, па се узорак концентрованог раствора разблажи до жељене концентрације.
Свакодневно, неколико пута, а да тога нисмо ни свесни, спроводимо поступак разблаживања раствора. На пример, паковање средстава за чишћење и кућне хигијене, као што су дезинфицијенси, саветује да се разблаже пре употребе. Неки произвођачи на етикетама производа предлажу да се разблажи водом у пропорцији 1 до 3, односно за сваки део производа морају се додати 3 дела воде. То се ради јер је производ веома концентрован и јак и може оштетити место на коме ће се применити ако се не разблажи на прави начин. С друге стране, ако га разблажите више него што би требало, можете изгубити новац, јер производ неће постићи жељени резултат.

Други пример је када правимо сокове. Ознаке многих концентрата сокова указују на то да чашу сока треба разблажити или помешати са 5 чаша воде. Дакле, сок постаје „слабији“, односно мање концентрован.
Замислите да сте такав сок разблажили у 3 Л воде. Ако је почетна концентрација сока била 40г / Л, то значи да је имао масу од 40г за сваки литар растварача. Али пошто ћемо имати 3 Л, маса ће бити подељена са 3 и концентрација ће тада бити приближно 13, 33 г / Л, или 13 грама за сваки литар раствора. Међутим, у целокупном раствору маса растворене супстанце од 40 г и даље остаје.
Израчун ове нове концентрације може се извршити на следећи начин:
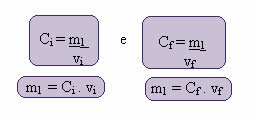
Где индекси и и ф представљају, односно, почетну и коначну вредност. Пошто се вредност м1 није променила, можемо изједначити једначине:
Ци. ви = Ц.ф. вф
Замените вредности које имамо, према претходном примеру, напомена:
Иницијално решење:
Ци: 40г / л
м1: 40г
ви: 1Л
Коначно решење:
Цф: ?
м1: 40г
вф: 3Л
Ци. ви = Ц.ф. вф
(40 г / Л). (1 Л) = Ц.ф. 3Л
Цф = 40 г / л
3
Цф = 13,333 г / л
Исто образложење важи и за моларну концентрацију (М) и за масени проценат растворене супстанце или титра (Т):
М.и. ви = М.ф. вф и Т.и. ви = Тф. вф
Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/diluicao-solucoes.htm

