Нека једињења не морају да имају осам електрона у валентној љусци да би постигла стабилност, па се сматрају изузецима од правила октета. Научите сада зашто неки елементи избегавају обавезу да имају октет електрона у последњој љусци.
Берилиј (Бе)
Изузетак је од правила октета јер је у стању да формира једињења са две једноструке везе, па се тако стабилизује са само четири електрона у валентној љусци. 
Пошто водоник (Х) треба да се одрекне два електрона да би створио везу (Х - Па - Х), атом берилијума (Бе) дели своје електроне и постиже стабилност.
Алуминијум (Ал)
Изузетак је од правила октета јер постиже стабилност са шест електрона у валентној љусци. Атом алуминијума има тенденцију да донира своје електроне и тако може створити три појединачне везе са другим атомима: 
У овом случају, алуминијум (Ал) је створио три везе са три атома флуора (Ф).
Бор (Б)
Твори молекуларне супстанце са три једноструке везе. 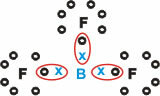
Имајте на уму да бор (Б) има тенденцију да донира своје електроне атомима флуора (Ф), који се придржавају правила октета, захтевајући осам електрона у валентној љусци. Како се бор предаје својим електронима, флуор се стабилизује са формираним октетом.
Написала Лириа Алвес
Дипломирао хемију
Бразилски школски тим
Види више!
Теорија октета
Општа хемија - Хемија - Бразил Сцхоол
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/excecoes-regra-octeto.htm
