О. атомски радијус (р) обично се дефинише као половина растојања између два језгра суседних атома, као што доња слика представља:

атомски радијус
Атомски радијус се разликује од једног атома до другог према својој породици и периоду на Периодном систему. У погледу елемената који припадају а исте породице, њен атомски радијус се повећава са повећањем атомског броја., односно од врха до дна. Јер, у овом смислу то значи да се од једног до другог атома повећао ниво енергије или електронски слој, па се његов радијус пропорционално повећава.
У погледу елемента у истом периоду, односно хоризонтално, радијус се повећава здесна налево или како се атомски број смањује. То је зато што сви имају исти број слојева, а разлика је у количини електрона у овим слојевима, и што више електрона, то је већа привлачност језгру, смањујући тако радијус атом.

Правац раста атомског радијуса према породици и периоду у Периодном систему
Међутим, атомски радијус може да варира у зависности од везе која је успостављена. Погледајмо како се ово дешава:
*Јонска веза: Ако атом твори а катиону, атомски радијус ће се смањивати, будући да губи један или више електрона, језгро ће интензивније привлачити електроне. Сада ако формирају анион, односно добијају електроне, полупречник атома ће се повећавати, јер ће укупан набој електросфере бити већи од укупног наелектрисања језгра, смањујући његово привлачење. Што више електрона добијете или изгубите, већа ће бити разлика у величини зрака.
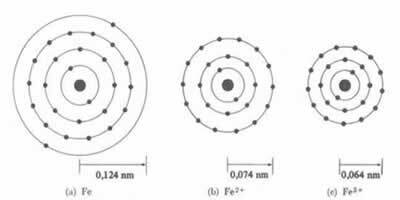
Пречник или полупречник катјона је увек мањи од пречника или полупречника атома
Такође, у низу изоелектронски јони, који имају једнаку количину електрона и енергетских нивоа, јон са најмањим атомским бројем имаће већи радијус. На пример, јони 13Ал3+, 12мг2+, 11У1+, 9Ф-1, 8О.2- и 7Н.-3, сви имају 10 електрона и 2 електронска нивоа. Али оно што има највећи радијус је 7Н.-3, јер има најмањи атомски број (З = 7).
*Ковалентна веза: Када два атома направе ковалентну везу, ако су два атома једнака, као у случају водоничног гаса (Х.2), може се говорити о ковалентном полупречнику (р), који је половина дужине везе (д), односно пола раздаљине која раздваја два језгра. Иако, ако везу везују различити атоми, као у случају водоник-хлорида (ХЦл), дужина или растојање (д) биће збир ковалентних полупречника (р1 + р2) атома који су укључени у ковалентност.
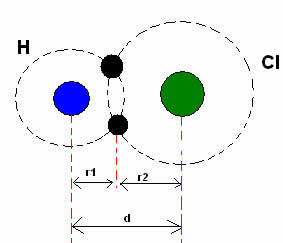
Збир атомских полупречника у ковалентној вези.
Наравно, морамо запамтити да је ово питање много сложеније, јер ковалентни радијус атома може варирати док се веже са другим различитим атомима.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm
