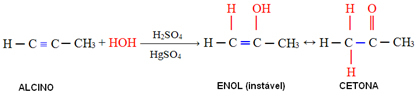
ТХЕ теорија октета је предложио Невтон Левис, који је у студијама приметио да се атомска интеракција дешава тако да сваки елемент стиче електронску стабилност племенитог гаса, односно осам електрона у валентни слој. Међутим, у неким молекулима се дешава оно што се назива експанзијом или контракцијом октета, односно централни атом успоставља мање или више предвиђене везе.
Прочитајте такође: Ковалентна веза - класификације и карактеристике
Како функционише теорија октета?
Наравно, сви системи теже да траже пут до стекну што већу стабилност, и ово није другачије са атомом. Атоми су „основне честице“ било које материје и свака у својој структури има електросферу. Ова електросфера је била подељена са Линус Паулинг у нивоима енергије и поднивоима. Паулинг је развио дијаграм да покаже како би изгледала расподела електрона око језгра атома.
Погледајте слику испод:

Сваки ниво и подниво садржи по електрони. Правећи аналогију, можемо рећи да је сваки ниво полица, а сваки подниво кутија. У сваку кутију станите по два електрона. Атом је стабилан када су сви његови електрони упарени, односно када постоје све кутије са по два електрона.
Пример:
Урадимо електронску расподелу кисеоника (О) који у свом природном стању има осам електрона.

Приметите да у валентном слоју (Л слој, у под нивоу) имамо два неспарена електрона. Управо ти електрони успостављају хемијске везе са другим елементима у потрази за формирањем електронских парова.
Теорија октета заснива се на математици збрајања електрона. Ако сви поднивои последње електронске љуске имају по два електрона, валентна љуска имаће укупно осам електрона и, према томе, атом ће бити стабилан.
Прочитајте такође: Квантни бројеви - бројеви повезани са количином енергије електрона
племените гасове
Племенити гасови су једини елементи који може се наћи у природи у моноатомском облику, односно без успостављања везе са другим атомом. То је зато што имају електронску стабилност. Готово сви имају осам електрона у валентној љусци., поштујући правило октета, са изузетком гаса хелијума, који има само два електрона.

Изузеци од теорије октета
Нека једињења успевају да се стабилизују са више или мање од осам електрона у валентној љусци. У тим случајевима се јављају изузеци од теорије октета.
проширење октета
То се углавном дешава са фосфором (П) и сумпором (С), који су релативно велики атоми и имају „д“ подниво. У овом случају, атом у својој последњој љусци држи више од осам електрона.
Пример:

У случају сумпорног хексафлуорида, централни елемент је остао 12 електрона, премашујући 8 потребних за стабилизацију према правилу октета. У овом случају дошло је до проширења октета.
контракција октета
Дешава се са берилијумом (Бе), бором (Б) и неким оксиди азота. Погледајте пример:

У случају борног трифлуорида, атоми флуора добијају потребних осам електрона у валентној љусци дељењем електронски са бором, поштујући правило октета, али централни атом (бор) се не стабилизује са шест електрона, па настаје једно контракција октета.
Такође приступите: Класификација сигма везе: који су критеријуми?
Вежбе решене
Питање 1 - (Мацкензие-СП) Да би атоми сумпора и калијума добили електронску конфигурацију једнаку конфигурацији племенитог гаса, потребно је да:
(Подаци: атомски број С = 16; К = 19.)
А) сумпор прима 2 електрона, а калијум 7 електрона.
Б) сумпор даје 6 електрона, а калијум 7 електрона.
В) сумпор даје 2 електрона, а калијум 1 електрон.
Г) сумпор прима 6 електрона, а калијум 1 електрон.
Е) сумпор прима 2 електрона, а калијум 1 електрон.
Резолуција
Алтернатива Е. Сумпор је елемент колоне 16 или породице 6А. Елементи ове породице теже да приме два електрона у електронске парове и имају укупно осам електрона у валентној љусци. Елементи породице 1А, а то су алкални метали, имају само један електрон у валентној љусци. Давањем овог електрона, претходни слој постаје валентни слој, већ са осам електрона, како налаже правило октета.
Питање 2 - Оцените следеће изјаве као истините (Т) или нетачне (Ф).
И () Правило октета каже да је у валентној љусци потребно осам електрона да би атом био стабилан.
ИИ () Валентни слој је други електронски слој атома.
ИИИ () Хлор (Цл), из породице халогена, тежи да добије два електрона да би стекао стабилност.
ИВ () Натријум (На), елемент породице 1А, тежи да изгуби једини електрон у својој валентној љусци.
Означите тачну алтернативу:
А) И, ИИИ и ИВ су тачни.
Б) И и ИВ су тачни.
В) Истина је само ИИ.
Д) Само ИВ је нетачан.
Е) Све су истините.
Резолуција
Алтернатива Б. И и ИВ су тачни. Изјава ИИ је нетачна, јер је валентни слој последњи електронски слој атома, а не други. А изјава ИИИ каже да хлор тежи да добије два електрона, што не проверава, будући да је хлор из Породица 7А или 17 тежи да добије само један електрон да би на тај начин стекла електронску конфигурацију гаса племенита.
Аутор Лаиса Бернардес Маркуес де Араујо
Наставник хемије