Научите да примењујете први закон термодинамике у различитим ситуацијама, решавајте вежбе и проверавајте своје знање решеним и објашњеним вежбама.
Питање 1
Први закон термодинамике каже да:
а) Енергија се не може створити или уништити, али се може претворити из једног облика у други.
б) Енергија је увек очувана, али се не може претворити из једног облика у други.
ц) Енергија се може створити или уништити, али се не може претворити из једног облика у други.
г) Енергија се не може сачувати, али се може претворити из једног облика у други.
Први закон термодинамике је принцип очувања енергије, дакле у систему затворена, количина енергије остаје константна и може се само трансформисати из једног облика у други. друго.
питање 2
Претпоставимо затворени систем који прима 100 Ј топлоте док обавља рад од 50 Ј. Колика је промена унутрашње енергије система?
а) -50 Ј
б) 0 Ј
ц) 50Ј
г) 100Ј
д) 150Ј
Провера знакова:
Примљена топлота је позитивна К > 0.
Обављени рад је позитиван В > 0.
По првом закону имамо:
питање 3
Идеалан гасни систем размењује 500 џула топлоте са спољашњим окружењем. Под претпоставком да је овај процес изометријско хлађење, одредите рад и унутрашњу енергију, респективно.
а) 500 Ј и 0 Ј
б) - 500 и 0 Ј
в) 0 Ј и 500 Ј
г) 0 Ј и - 500 Ј
д) -500 Ј и 500 Ј
Пошто је процес изометријски, нема промене запремине, па је рад нула.
Према првом закону термодинамике:
Пошто се ради о хлађењу, систем губи топлоту, дакле:
питање 4
8 молова идеалног гаса у систему клип-цилиндар се компримује обављањем рада од 1000 Ј. Током процеса, 400 Ј топлоте се губи у спољашњу средину. Његова унутрашња енергија и промена његове температуре су, респективно, једнаке
Дато: Р = 8,31 Ј/мол. К
а) - 1400 Ј и приближна варијација од 6 К
б) 600 Ј и приближна варијација од 6 К
ц) 600 Ј и приближна варијација од 14 К
г) - 1400 Ј и приближна варијација од 14 К
унутрашња енергија
Како систем прима рад, његов предзнак је негативан, као и топлота која се у овом процесу губи.
Први закон термодинамике је:
Заменом вредности добијамо:
Р = 8,31 Ј/мол К
Температура
По Џуловом закону имамо:
питање 5
Савршен гас подлеже компресији, обављајући рад од 500 Ј. На крају ове трансформације унутрашња енергија система се променила 200 Ј мање него на почетку. Количина топлоте коју размењује гас је била
а) - 700 Ј
б) - 300 Ј
ц) 300Ј
г) 0Ј
д) 700 Ј
Пошто је рад примљен, односно отпоран рад, његов предзнак је негативан.
Замена вредности у једначину првог закона термодинамике:
питање 6
(ЦЕДЕРЈ 2021) У фази циклуса коју изводи идеалан гас у клима-уређају, притисак гаса се повећава одржавајући његову запремину константном. У овој фази циклуса, рад В који обавља гас, количина топлоте К коју он апсорбује и промена ΔТ његове температуре су, респективно:
а) В < 0, К < 0 и ΔТ < 0
б) В = 0, К > 0 и ΔТ > 0
ц) В = 0, К = 0 и ΔТ = 0
д) В > 0, К > 0 и ΔТ > 0
Подаци:
Повећава се притисак П;
Волумен остаје константан;
Рад
Како је запремина константна, рад В је једнак нули.
Први закон термодинамике гласи овако:
Пошто је топлота позитивна, промена унутрашње енергије ће такође бити позитивна.
Топлота
Пошто се топлота апсорбује, она је позитивна.
Температура
По закону о гасу:
Где,
н је број молова
Р је универзална гасна константа
Дакле, температура зависи само од притиска, пошто је запремина константна и позитивна.
питање 7
(УНИЦЕНТРО 2018) Према Првом закону термодинамике, промена унутрашње енергије система, ΔУ, је дато разликом између топлоте размењене са спољним окружењем, К, и рада, В, обављеног у процесу термодинамички. Узимајући у обзир ове информације, ако се једноатомски гас шири тако да увек остане на истој температури, ова трансформација се може представити једначином
а) ΔУ + В = 0
б) ΔУ − В =0
в) К − В = 0
г) К + ΔУ = 0
Изотермни процес се одвија без промене температуре.
Енергија је повезана са температуром на следећи начин:
Где је н број молова, а Р је универзална гасна константа. Пошто су н и Р константни, постоји само температурна варијација, и
Први закон термодинамике гласи овако:
питање 8
(УРЦА 2016) Према првом закону термодинамике, ако током изотермног процеса који пролази кроз идеалан гас фиксне масе, гас се ослобађа количина топлоте чија је величина 50 цал тада су промена унутрашње енергије и рад који гас обавља у овом процесу, редом:
а) 0 и 50 кал.
б) 50 кал и 0.
в) 0 и 0.
г) 50 кал и -50 кал.
д) 0 и -50 кал.
Промена унутрашње енергије је директно повезана са променом температуре. Како је процес изотермичан, нема промене температуре, па .
Из првог закона термодинамике:
Пошто се топлота ослобађа, њен предзнак је негативан.
питање 9
(УФРН 2012) Биомаса је један од главних извора обновљиве енергије и стога су машине које је користе као гориво за производњу електричне енергије важне са еколошке тачке гледишта. Веома чест пример је употреба биомасе за погон парне турбине за стварање посла. На слици са стране је шематски приказана поједностављена термоелектрана.
У овој термоелектрани, сагоревањем биомасе у пећи настаје топлота, која загрева воду у котлу и ствара пару под високим притиском. Пара се, пак, води кроз цеви до турбине која под њеним дејством почиње да окреће своје лопатице.
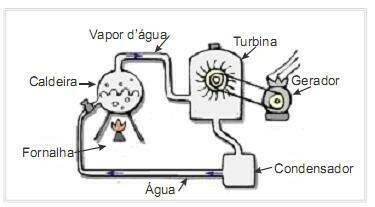
Претпоставимо да су губици топлоте услед температурних разлика између делова овог топлотног мотора и околине занемарљиви. У овом контексту, варијација унутрашње енергије котловске воде
а) већа је од збира топлоте која му се даје сагоревањем биомасе и рада на турбини.
б) једнака је збиру топлоте која му се испоручује сагоревањем биомасе са радом на турбини.
в) једнака је разлици између топлоте која јој се даје сагоревањем биомасе и рада на турбини.
г) већа је од разлике између топлоте која му је достављена сагоревањем биомасе и рада на турбини.
Вода у котлу добија енергију у виду топлоте сагоревањем горива и ослобађа енергију у виду рада на турбини.
питање 10
(УЕЦЕ 2021) Што се тиче својстава гасова, обратите пажњу на следеће изјаве:
и. За идеалан гас, унутрашња енергија је функција само притиска.
ИИ. Топлота коју гас апсорбује при промени свог стања је независна од процеса.
ИИИ. Унутрашња енергија идеалног гаса је функција само температуре и независна је од процеса.
ИВ. У изотермној експанзији идеалног гаса, рад који он изврши једнак је апсорбованој топлоти.
Тачно је оно што је наведено само у
а) И и ИИ.
б) ИИИ и ИВ.
ц) И и ИВ.
г) ИИ и ИИИ.
ИИИ. ТАЧНО. Унутрашња енергија идеалног гаса је функција само температуре и независна је од процеса.
Промена унутрашње енергије је директно повезана са променом температуре.
Где је н број молова, а Р идеална гасна константа, пошто су константе, само температура одређује унутрашњу енергију гаса.
ИВ. ТАЧНО. У изотермној експанзији идеалног гаса, рад који он изврши једнак је апсорбованој топлоти.
Пошто је изотермна, нема промене температуре, па је промена унутрашње енергије нула. По првом закону термодинамике:
Сазнајте више са:
- Први закон термодинамике
- Термодинамика: закони, појмови, формуле и вежбе
- Вежбе из термодинамике
- закон о гасу
АСТХ, Рафаел. Вежбе првог закона термодинамике.Алл Маттер, [н.д.]. Доступна у: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Приступ на:
Види такође
- Вежбе из термодинамике
- Термодинамика
- адијабатска трансформација
- Вежбе из термохемије
- Први закон термодинамике
- Природне науке и њихове технологије: Енем
- Топлотна енергија
- Други закон термодинамике
