осмоскопија је заједничко власништво (остали су тоноскопија, ебуллиосцопи и криоскопија) који проучава појаву осмоза између два раствора различитих концентрација, од којих је један концентрисанији од другог.
Напомена: Колигациона својства настају када се у раствор дода неиспарљива растворена супстанца.
Као такав осмоскопија проучавати осмозу, неопходно је знати Шта је овај феномен. За ово ћемо користити доња решења која су одвојена полупропусном мембраном:
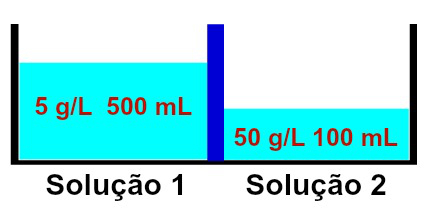
Представљање решења која имају различите концентрације
Примећено је да раствор 1 садржи концентрацију од 5 г / Л и запремину од 500 мл, док раствор 2 има концентрацију од 50 г / Л и запремину од 100 мл, одвојен мембраном полупропусна. Решење 2 је концентрисаније од раствора 1 и зато између њих мора настати осмоза.
Осмоза се нужно мора догодити из раствора 1 у раствор 2, јер је раствор 1 мање концентрован. Током ове појаве, део растварача прелази полупропусну мембрану, чинећи раствор запремином 2 повећавати и смањивати запремину раствора 1, све док оба раствора не почну да имају исту концентрацију, тј. изотонија.

Модификација висине раствора 1 и 2 услед појаве осмозе
Напомена: Изотонични медији су они чија је концентрација једнака.
Према осмоскопијадолази до осмозе јер је максимални притисак паре растварача у мање концентрованом раствору већи од притиска растварача у концентрованијем раствору. Сада, ако желимо да спречимо појаву осмозе, само извршите притисак на најконцентрисанији раствор:
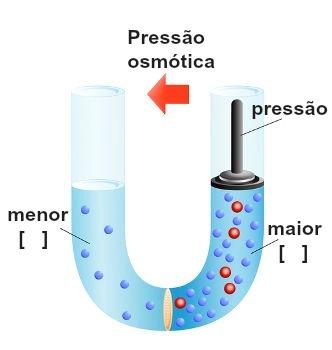
Приказ извршења притиска на најконцентрисанији раствор
Овај притисак, који се врши на најконцентрисанији раствор да би блокирао или чак обрнуту осмозу, назива се осмотски притисак а представљен је симболом π. Требало би да буде директно пропорционална концентрацији раствора.
Могуће интерпретације осмотског притиска
Према закључцима осмоскопија, сваки раствор има осмотски притисак, јер је то повезано са концентрацијом, карактеристиком присутном у сваком раствору.
Када упоређујемо један медијум или једно решење са другим, можемо користити следеће изразе:
Хипертонична: када један медијум представља осмотски притисак већи од другог;
хипотонична: када један медијум има осмотски притисак нижи од другог;
Изотонични: када два медија или раствори имају исти осмотски притисак.
Дакле, када се упоређују осмотски притисци два раствора А и Б, представљени са πТХЕ и πБ., можемо рећи да:
Ако су осмотски притисак А и Б једнаки, средства или решења биће изотонична:
πТХЕ = πБ.
Ако је осмотски притисак А већи од осмотског притиска Б, медијум А биће хипертоничан у односу на Б:
πТХЕ> πБ.
Ако је осмотски притисак Б мањи од осмотског притиска А, средина Б ће бити хипотонична у односу на Б:
πБ.< πТХЕ
Формула за израчунавање осмотског притиска
π = М.Р.Т
У овој формули:
π = је осмотски притисак
М = је концентрација у мол / л
Р = је општа гасна константа (0,082 за притисак у атм; 62,3 за притисак у ммХг)
Т = температура у Келвину
Како концентрација у мол / Л има одређену формулу, као што је приказано доле:
М = м1
М.1.В
Можемо га заменити у формули осмотског притиска:
π = м1.Р.Т
М.1.В
Напомена: Ако је растворена супстанца у раствору јонска, морамо користити Ван'т Хоффов корекциони фактор (и) у израчуну израчунавања осмотског притиска:
π = М.Р.Т.и
Пример прорачуна осмотског притиска
Пример: (УФ-ПА) Раствор који садржи 2 мг новог антибиотика, у 10 мл воде, на 25 ° Ц, производи осмотски притисак од 0,298 ммХг. Дакле, молекулска маса овог антибиотика је приближно:
а) 3000
б) 5200
в) 7500
г) 12500
д) 15300
Подаци добијени вежбом су:
π = 0,298 ммХг
Т = 25 О.Ц или 298 К (након додавања са 273)
м1 = 2 мг или 0,002 г (након дељења са 1000)
В = 10 мл или 0,01 Л (након дељења са 1000)
Р = 62,3 ммХг
Да бисте решили ову вежбу, једноставно примените доступне податке у изразу за израчунавање осмотског притиска, како следи:
π = м1.Р.Т
М.1.В
0,298 = 0,002.62,3.298
М.1.0,01
0.298.М1.0,01 = 37,1308
0.00298.М1 = 37,1308
М.1 = 37,1308
0,00298
М.1 = 12460 у
Ја сам, Диого Лопес Диас
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm

