А сублимација То је промена физичког стања материје коју карактерише директан прелазак из чврсте фазе у гасовиту фазу, без проласка кроз течну фазу. Строго говорећи, свака супстанца може бити подвргнута сублимацији, али под одређеним условима притиска и температуре. Сублимација је у корелацији са притиском паре у чврстој фази, као и са међумолекуларним интеракцијама које врше чврсте материје.
Овај процес се лако може посматрати у комаду сувог леда, који се састоји од чврстог угљен-диоксида. Угљен-диоксид сублимира под притиском и на собној температури. Процес супротан сублимацији може се назвати ресублимацијом или депозицијом. Да би дошло до сублимације, материја мора да апсорбује енергију, па се сматра ендотермним процесом.
Прочитајте такође: Која су физичка стања материје?
Резиме о сублимацији
Сублимација је директан прелазак из чврсте фазе у гасовиту фазу, без проласка кроз течну фазу.
Специфични услови притиска и температуре су неопходни да би се посматрала сублимација супстанце.
На сублимацију утичу термодинамички аспекти, као што су притисак паре у чврстој фази и међумолекулске интеракције.
Сублимација је ендотермни процес.
Пример сублимације је оно што се дешава у сувом леду, који се састоји од чврстог угљен-диоксида.
Шта је сублимација?
сублимација је директан прелазак из чврсте фазе у гасну фазу, без проласка кроз течну фазу. Јавља се под специфичним условима температуре и притиска за неке чврсте материје. Ова транзиција је физички процес промене стања, који не укључује хемијске реакције.
Обрнути процес, односно директан прелазак из гасовите фазе у чврсту фазу, назива се различито. Неки аутори задржавају реч сублимација за ову фазну промену, док други користе „поновну сублимацију“, па чак и „депозицију“.
Како сублимација функционише
Може се повући паралела између сублимације и испаравања. У оба случаја крајња тачка је гасна фаза. Разлика је, очигледно, у почетној фази: чврста за сублимацију и течност за испаравање.
У оба случаја, постоји утицај притиска испаравање и такође термодинамички аспекти, укључујући топлоту и међумолекулске интеракције.
Шта је притисак паре?
У затвореној посуди која садржи течност, могуће је уочити да постоји равнотежа између течне и парне фазе. Ово се дешава зато што је, чак и испод температуре кључања, присутна енергија довољна да се неки молекули течности одвоје и пређу у пару. Међутим, неки молекули паре такође могу поново да се кондензују и врате у течну фазу, што показује реверзибилност процеса.
Ова пара је направљена од материја (има масу и запремину), вежбе притисак на површину течности, познат као притисак паре. То не зависи од количине течности, већ од температуре, јер што је температура виша, молекули се лакше одвајају од течне фазе.
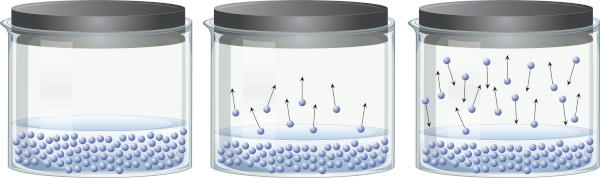
Течности које имају висок притисак паре на уобичајеним температурама називају се испарљивим. На пример, на 25°Ц, етил етар има притисак паре од 0,58 атм, ацетон (пропанон) има притисак паре од 0,29 атм, док вода има притисак паре од 0,023 атм. Иначе, када је притисак паре идентичан атмосферском, течност кључа. Да бисте сазнали више о притиску паре, кликните овде.
Притисак паре и сублимација
Иако у мањој мери, чврсте материје такође имају притисак паре, али много ниже од течности. На пример, чак и на температури од 1000 К, притисак паре гвожђа је само 9,21 к 10-20 атм. Међутим, неке чврсте материје успевају да се подвргну сублимацији, као што је јод, што представља већи притисак паре на нормалним температурама (4 к 10-4 атм).
Ово је могуће само уз прелазак молекула из чврстог стања директно у гасовито стање. Да би се ово десило, молекули чврсте материје морају бити присутни интермолекуларне интеракције слаб (у јоду, на пример, они су типа дипола индукованог диполом).
Такође се види да процес сублимације је ендотерман, односно постоји потреба да молекули чврсте материје апсорбују енергију у виду топлоте како би могли да прекину међумолекулске интеракције и пређу у стање паре. Количина укључене топлоте може се измерити термодинамичком величином познатом као енталпија сублимације.
Дијаграм фаза
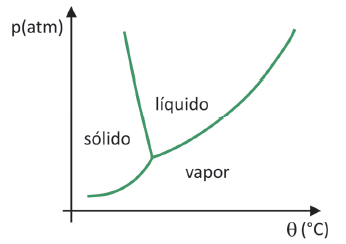
До да се зна у ком опсегу притиска и температуре ће доћи до сублимације чврсте материје, потребно је да процените свој фазни дијаграм. Хајде да погледамо случај угљен-диоксида, ЦО2.

У фазном дијаграму, граничне линије између стања (чврсто, течно и гасовито) спајају вредности притиска и температуре за долази до промене стања. Када се посматра случај ЦО2, примећује се да при притиску од 1 атмосфере, чврста фаза прелази директно у парну фазу на температури од -78,5 °Ц, што карактерише сублимацију.
Угљен-диоксид има само течну фазу при притисцима изнад 5,11 атмосфера, а изнад тог притиска сублимација више није могућа. Да бисте сазнали више о фазном дијаграму, кликните овде.
примери сублимације
Суви лед: суви лед, који се често користи за стварање ефеката магле на забавама и догађајима, заправо је угљен-диоксид у чврстом стању.

нафталин: нафталин се прави од нафталена, ароматичног органског једињења. Примењује се за уклањање непријатних мириса, а такође и за плашење мољаца, бубашваба и других отровних животиња, због чега је уобичајено да се користе у ормарима или чак у писоарима.

Камфор: Са карактеристичним мирисом, камфорски шљунак такође може бити подвргнут сублимацији. Они такође служе за уплашивање комараца и спречавање буђи.

јод: неметал који припада халогенима такође подлеже сублимацији.

Међутим, међу представљеним супстанцама, само угљен-диоксид подлеже сублимацији у амбијенталним условима. Остали, чак и уз сублимацију, могу да се подвргну нормалној фузији под притиском у којем живимо.
Прочитајте такође: Плазма — четврто стање материје
Решене вежбе на сублимацији
Питање 1
(Фувест 2020) У супермаркетима је уобичајено пронаћи такозвану замрзнуту храну, као што су воће, поврће и месо. Лиофилизирана храна је и даље погодна за конзумирање након дужег времена, чак и без хлађења. Израз „лиофилизован” у овој храни односи се на процес замрзавања и накнадну дехидрацију сублимацијом воде. Да би дошло до сублимације воде, потребна је комбинација услова, као што је приказано на графикону притисак-температура, где линије представљају фазне прелазе.
Упркос томе што је процес који захтева, индустријски, употребу одређене технологије, постоје докази да народи Претколумбовци који су живели у највишим пределима Анда могли су да замрзавају суву храну, што је омогућавало да је чувају за више времена. Проверите алтернативу која објашњава како је дошло до природног процеса сушења замрзавањем:
а) Сублимација воде је настала услед ниских температура и високог атмосферског притиска у планинама.
б) Храна је, након природног замрзавања у хладним периодима, одношена на најнижи део планина, где је био нижи атмосферски притисак, што је омогућило сублимацију.
ц) Храна је била изложена сунцу да би се повећала температура, а низак локални атмосферски притисак је погодовао очвршћавању.
д) Температуре су биле довољно ниске у хладним периодима да замрзну храну, а низак атмосферски притисак у високим планинама омогућио је сублимацију.
е) Намирнице су, након што су биле природно замрзнуте, пресоване да би се повећао притисак, тако да је дошло до сублимације.
Одговор: Писмо Д.
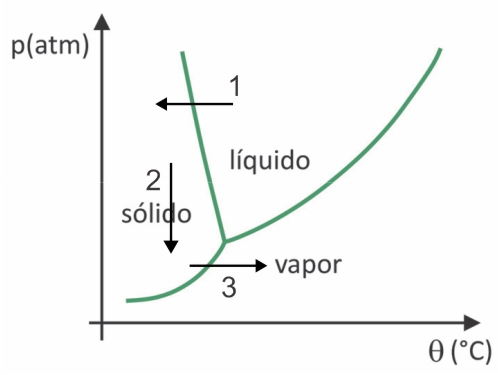
У лиофилизацији долази до замрзавања воде са њеном накнадном сублимацијом. Преколумбијски народи могли су да спроведу такав процес, јер би зими вода могла да се смрзне (стрелица 1) и, са ниским притисцима (стрелица 2) највиших региона Анда, могао би да се подвргне сублимацији (стрелица 3).
питање 2
(Уерј 2005) Суви лед, или очврснути угљен-диоксид, који се широко користи у процесима хлађења, подлеже сублимацији у амбијенталним условима. Током ове трансформације јављају се, између осталог, феномени варијације енергије и поремећаја интеракција.
Ови феномени су класификовани, респективно, као:
а) егзотермни – међујонски
б) егзотермни – интернуклеарни
в) изотермни – међуатомски
г) ендотермни – интермолекуларни
Одговор: Писмо Д.
Сублимација је ендотермни процес, јер захтева апсорпцију топлоте да би се пореметиле интеракције које одржавају компактне молекуле чврсте фазе. Ове интеракције су интермолекулског типа.
Аутор Стефано Араухо Новаис
наставник хемије
