ТХЕ дестилација је метода одвајања хомогених смеша, односно када су компоненте у једној фази.
Постоје две врсте дестилације. Једноставна дестилација се користи у раздвајању чврстог и течног и фракционој дестилацији у мешавини течности које се међусобно мешају.
Да бисте могли да изолујете одређену компоненту смеше, потребно је модификовати променљиву. У случају дестилације, до раздвајања долази променом температуре тако да компонента од интереса мења своје физичко стање.
Својство супстанци које се користе у овом процесу је тачка кључања, односно температура на којој долази до промене из течности у гас.
процес дестилације
Процес дестилације се састоји од довођења топлоте у смешу док се не достигне тачка кључања компоненте од интереса и она пређе у гасовито стање, одвајајући се од осталих.
Након тога, гас пролази кроз расхладну колону, где ће се топлота уклањати из супстанце док не достигне тачку топљења и тако се враћа у течно стање. Овај материјал се усмерава у други контејнер.
једноставна дестилација
Одвојити хомогену смешу од чврста растворена у течности користи се једноставна дестилација.
На слици испод можемо видети основну опрему за процес одвајања.

Да ли су они:
- Дестилациони балон (1), који садржи смешу;
- Покривач за загревање (2), који даје топлоту смеши;
- Термометар (3), за праћење промене температуре;
- Кондензатор (4), за хлађење испарене компоненте и
- Чаша (5), за сакупљање издвојене компоненте у течном стању.
Овај процес се може користити, на пример, за одвајање натријум хлорида (НаЦл), познатог као кухињска со, и воде. Со има тачку кључања од 1465 °Ц и раствара се у води да би се формирала хомогена смеша.
Како вода има тачку кључања од 100 ºЦ, лако прелази у гасовито стање и издваја се из смеше, док се со кристализује и остаје у чврстом стању у посуди.
Водена пара излази на врху боце за дестилацију и пролази кроз кондензатор. По зидовима ове опреме циркулише хладна или хладна вода. Размена топлоте између флуида узрокује да одвојена компонента смеше губи топлоту и враћа се у течно стање да би се прикупила у другом контејнеру. Ова течност се назива дестилат.
фракционом дестилацијом
Одвојити хомогену смешу од течности које се мешају једна са другом а са великом разликом између температура кључања користи се фракциона дестилација.
Ова метода је фракционисана јер су компоненте одвојене од смеше у растући ред тачке кључања, односно почевши од најниже до оне која захтева највишу температуру за промену фазе.
На слици испод је опрема која се користи за извођење методе.
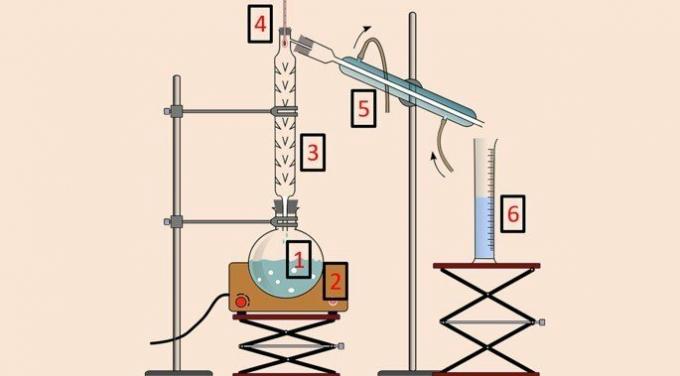
Као и у једноставној дестилацији, користе се дестилациона боца (1), грејни покривач (2), термометар (4), кондензатор (5) и чаша (6). Међутим колона за дестилацију или фракционисање (3) је опрема која омогућава одвајање према температури.
Колона за дестилацију има низ препрека унутар себе како би се спречило да све компоненте смеше испаре у исто време.
Овај процес се широко користи за одвајање фракција нафте, која је мешавина угљоводоника. Неке од компоненти нафте и њихове одговарајуће тачке кључања (ПЕ) су: бутан (ПЕ 20 ºЦ), бензин (ПЕ 150 ºЦ) и керозин (ПЕ 300 ºЦ).
Фракционом дестилацијом се прва компонента издваја бутан, јер има најнижу тачку кључања, затим бензин, са средњом тачком кључања, и на крају керозин.
Апликације за дестилацију
Дестилација се широко користи у индустрији, јер многе смеше пролазе кроз овај процес. Алкохолна пића као што су виски, ракија и вотка се праве на овај начин.
Петрохемијска индустрија користи фракциону дестилацију за пречишћавање нафте. Дестилационе куле су велике структуре направљене да одвајају фракције овог фосилног горива.

Вежбе дестилације
Питање 1
Дестилација је метода раздвајања заснована на својствима.
хемија
б) Физика
ц) Биолошки
д) Опште ствари
Алтернатива: б) Физика.
Тачка кључања је специфично физичко својство материје, јер је инхерентно датој супстанци. То је температура на којој материјал прелази из течног у гасовито стање, односно подлеже испаравању.
питање 2
Ово су примери смеша одвојених дестилацијом, ОСИМ
а) вода + ацетон
б) саламуру
в) вода + уље
г) морска вода
Тачна алтернатива: в) вода + уље.
Вода и уље су супстанце које се не мешају. У овом случају, метода декантације се користи за одвајање компоненти смеше. Ова метода се заснива на разлици у густини.
Саламури (вода + со) и морска вода, која такође има растворене соли, одвајају се једноставном дестилацијом. За воду и ацетон се користи фракциона дестилација.
питање 3
(УФРГС) Двофазни хетерогени систем формирају три различите течности А, Б и Ц. Познато је да:
А и Б се међусобно мешају;
Ц се не меша са А и са Б;
А је нестабилнији од Б.
На основу ових информација, најпогодније методе за одвајање три течности су:
а) центрифугирање и декантирање.
б) декантацију и фракционо топљење.
в) филтрирање и центрифугирање.
г) филтрација и фракциона дестилација.
д) декантацију и фракциону дестилацију.
Исправна алтернатива: е) декантација и фракциона дестилација.
Хетероген систем питања има две фазе:
Фаза 1: течности А и Б, које се међусобно мешају
Фаза 2: течност Ц, која се не меша са осталим компонентама
Дакле, због разлике у густини, фаза 1 се одваја од фазе 2 методом декантације. Због разлике у температури кључања, пошто је А испарљивији од Б, односно тежи да лако пређе у гасовито стање, користи се фракциона дестилација.
Стекните више знања уз садржај:
- Једноставна и фракциона дестилација
- Одвајање смеша
- Вежбе раздвајања смеша