Главна карактеристика редокс реакција је да истовремено једна хемијска врста губи електроне (оксидацијом), а друга добија електроне (редукцијом).
Међутим, у одређеним реакцијама могуће је приметити да не постоји само оксидација и/или редукција. Испод је пример:
СнС + ХЦл + ХНО3 → СнЦл4 + С + НЕ + Х2О
Израчунавајући оксидационе бројеве (Нок) свих атома у овој реакцији, као што је наведено у тексту „Одређивање оксидационог броја (Нок)“, имамо:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
СнС + ХЦл + ХНО3 → СнЦл4 + С + НЕ + Х2О
Хајде сада да проверимо којесупстанце су претрпеле варијације у свом Нок и, последично, које су оксидисале и редуковале:
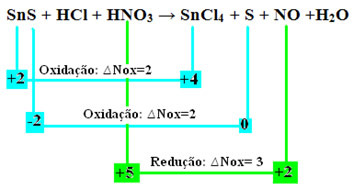
Имајте на уму да су се догодиле две оксидације. Дакле, у том случају, како уравнотежити хемијску једначину?
Једна важна ствар коју треба имати на уму која се односи на све редокс реакције је да број предатих електрона увек мора бити једнак броју примљених електрона.
Стога, да бисте уравнотежили ову врсту реакције, придржавајте се истих правила утврђених у тексту "
Редок балансирање“, међутим, са само једном променом: одређивање варијације Нок (∆Нок) врста које су изазвале две оксидације (СнС) биће збир два ∆Нок, што ће нам дати укупну вредност изгубљених електрона:- СнС: ∆Укупни Нок = (∆Нок СнЦл4) + (∆Нок С)
СнС: ∆Укупни НОк = 2 + 2 = 4
- ХНО3: ∆Нок = 3
Дакле, можемо наставити са следећим корацима за балансирање:
Не заустављај се сада... Има више после реклама ;)
- СнС: ∆Укупни НОк = 4 → 4 биће ХНО коефицијент3;
- ХНО3: ∆Нок = 3 → 3 биће коефицијент СнС.
3 СнС + ХЦл + 4 ХНО3 → СнЦл4 + С + НЕ + Х2О
Наставак балансирања пробном методом:
- Пошто имате 3 Сн и 3 С у 1. члану, ово ће такође бити ваши коефицијенти у 2. члану:
3 СнС + ХЦл + 4 ХНО3 → 3 СнЦл4 + 3 И+НЕ+Х2О
- Тиме је 2. члану остало 12 Цл (3. 4 = 12), па ће 12 бити коефицијент супстанце у којој се Цл налази у 1. члану, а то је ХЦл:
3 СнС + 12 ХЦл + 4 ХНО3 → 3 СнЦл4 + 3 С + НО + Х2О
- Сада имамо 16 Х у 1. члану (12 + 4 = 16), па стога коефицијент Х2О ће бити једнако 8, јер 8 помножено са водоничним индексом, који је 2, даје 16:
3 СнС + 12 ХЦл + 4 ХНО3 → 3 СнЦл4 + 3 С + НЕ +8Х2О
- Даље, у 1. члану такође постоји 4 Н, па ће 4 такође бити коефицијент Н у 2. члану:
3 СнС + 12 ХЦл + 4 ХНО3 → 3 СнЦл4 + 3 С + 4 НО +8 Х2О
Имајте на уму да је количина кисеоника у 1. екстремитету (3. 4 = 12) једнако је укупној количини тог елемента у 2. краку (4 + 8 = 12). Дакле, реакција је уравнотежена.
Аутор: Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
ФОГАЦА, Јеннифер Роцха Варгас. „Реакције са више од једне оксидације и/или редукције”; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. Приступљено 27. јула 2021.