- Неутрални медиј:
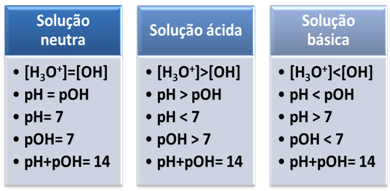
Медиј се сматра неутралним ако има исту концентрацију, у мол/Л, хидронијум јона (Х3О+) и хидроксид (ОХ-).
Пример неутралног медијума који чак служи и као стандард за друга раствора је чиста, дестилована вода на температури од 25ºЦ. На овој температури има тачно 1. 10-7 мол/Л оба јона. Дакле, ваш јонски производ (Кв) је једнако 10-14 (мол/Л)2:
Кв = [Х3О+]. [ох-]
Кв = (1. 10-7 мол/Л). (1. 10-7 мол/Л) = 10-14 (мол/Л)2
пХ и пОХ су дати у наставку:
пХ= - лог [Х3О+] пОХ= -лог[ОХ-]
пХ= - лог 1. 10-7 пОХ= - лог 1. 10-7
пХ = 7пОХ = 7
Ово нам показује да је у неутралном решењу пХ је једнак пОХ.
- кисели медијум:
У киселој средини концентрација Х јона3О+ је већи од ОХ јона-.
Такво решење се може постићи додавањем малог дела Х јона3О+, на пример, помоћу киселине.
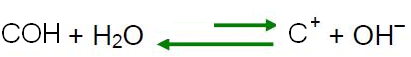
Према Ле Шателијеовом принципу, када дође до поремећаја у систему у равнотежи, он тежи да се поново прилагоди како би смањио ефекте ове силе. То значи да ако се у воду дода киселина, Х јони3О+ они ће бити у вишку и равнотежа ће се померити у смеру обрнуте реакције, улево. Дакле, ови вишак јона ће реаговати са ОХ јонима
-. Дакле, концентрација ОХ јона- ће се смањити и раствор ће постати кисел.Не заустављај се сада... Има више после реклама ;)

Јонски производ (Кв) је увек једнак 10-14, али концентрација Х јона3О+ већа је од концентрације ОХ јона-1. Дакле, пХ је већи од пОХ у киселој средини, али је његов збир увек једнак 14.
Такође, већа је концентрација Х јона3О+, што је већа пХ вредност. На собној температури (25°Ц), пХ < 7 и пОХ > 7.

- Основно значи:
У основној средини концентрација ОХ јона- је већи од Х јона3О+.
Ако додамо базу у воду, то значи да додајемо ОХ јоне.- и, као што је објашњено у претходној тачки, по Ле Шателијеовом принципу, равнотежа реакције самојонизација воде ће се кретати у супротном смеру, а вишак јона реагује са Х јони3О+, смањујући вашу концентрацију и чинећи решење основним.
У том случају, пОХ ће бити већи од пХ. На собној температури (25°Ц), пХ > 7 и пОХ < 7.

Укратко:
Аутор: Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
ФОГАЦА, Јеннифер Роцха Варгас. „Неутрални, кисели и базни медији”; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Приступљено 27. јула 2021.