реакције са базични оксиди су хемијске појаве у којима се супстанца ове класе оксида ставља у исти контејнер као а неорганска киселина, а кисели оксид или један амфотерни оксид.
Погледајте такође:Реакције са амфотерним оксидима
неорганска со и вода су уобичајени производи у а реакција са основним оксидима. Да бисмо сазнали да ли ће се производити неорганска со или вода, морамо погледати супстанцу која прати основни оксид у реагенсу. Погледајте примере у наставку и схватите како се овај процес одвија.
Реакције са базним оксидима и неорганским киселинама
У реакцијама између базних оксида и неорганских киселина настају неорганска со и вода, јер основни оксидни катјон (И+) ступа у интеракцију са ањоном (Кс-) киселине и хидронијум катјона (Х+) киселине ступа у интеракцију са ањоном оксида:
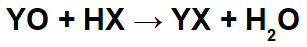
Пример: Радијум оксид и бромоводонична киселина
У овој реакцији имамо радијум оксид (РаО) и бромоводончну киселину (Хбр) као реактанте. Дакле, долази до следећих интеракција:
Радио катјон (Ра+2) са бромидним ањоном (Бр-1) формирајући со радијум бромида (РаБр2).
Хидронијум катјон (Х+1) са оксидним ањоном (О-2) формирање воде (Х2О).
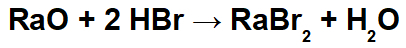
Погледајте такође:Реакције са двоструким оксидима
Реакције са базичним оксидима и киселим оксидима
У овим реакцијама, неорганска со се формира интеракцијом између основног оксидног катјона (И+) и резултујући кисели ањон (ВОТхе-) хемијске реакције између киселог оксида и воде.
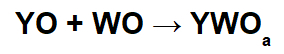
Пример: Натријум оксид и сумпор диоксид
У овој реакцији имамо натријум оксид (На2О) и сумпор диоксид (СО2). Важно је напоменути да, у почетку, када кисели оксид интерагује са водом, долази до формирања сумпорне киселине (Х2САМО3):
Не заустављај се сада... Има више после реклама ;)

Од формирања ове киселине долази до интеракције између катјона натријума (На+1) основног оксида и сулфитног ањона (СО3-2) киселине, формирајући со натријум сулфита (На2САМО3):
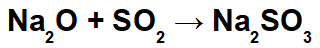
Реакције са базичним оксидима и амфотерним оксидима
Амфотерни оксиди су супстанце које показују двоструко хемијско понашање: у присуству киселе супстанце, понаша се као базни оксид; у присуству супстанце базичне природе понаша се као кисели оксид.
Дакле, када а основни оксид реагује са амфотерним оксидом, ово ће се понашати као кисели оксид, формирајући неорганску киселину у присуству воде. Реакција између ањона неорганске киселине и катјона базног оксида ће формирати производ соли.
Пример: Калијум оксид и хром ИИИ оксид
У овој реакцији имамо калијум оксид као реактанте (К2О) и хром оксид (Цр2О3). Важно је напоменути да, у почетку, када амфотерни оксид интерагује са водом, долази до формирања хромозомске киселине (2ХЦрО2):

Од формирања ове киселине долази до интеракције између катјона калијума (К+1) основног оксида и хромитног ањона (СО3-2) киселине, формирајући со калијум хромита (2КЦрО2):

Од мене Диого Лопес Диас
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
ДАНИ, Диого Лопес. „Реакције са основним оксидима“; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/reacoes-com-oxidos-basicos.htm. Приступљено 27. јула 2021.
Номенклатура соли, класификација соли, име ањона, име катјона, гвожђе сулфат, гвожђе сулфат, нитрат сребра, калијум хлорида, натријум хлорида, калцијум хлорида, сребрног нитрата, бакар сулфата, карбоната калцијум.



