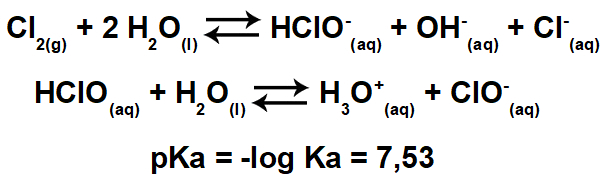Молекули супстанци нису сви равни, као да су у једној равни. На крају крајева, они су расути у свемиру и њихови атоми попримају различите распореде или распореде. Дакле, постоје различити геометријски облици за молекуле сваке врсте супстанце.
Један од најједноставнијих начина за одређивање геометрије молекула заснива се на теорији о одбијање електронских парова валентне љуске (РПЕЦВ). Према овој теорији, електронски парови централног атома функционишу као електронски облаци који се међусобно одбијају. На тај начин су оријентисани што даље један од другог. Геометрија молекула зависиће од броја електронских парова око централног атома.
Овај електронски облак може бити састављен од електрона који учествују у везама (једноструким, двоструким или троструким), али и који не учествују. Дакле, имамо:
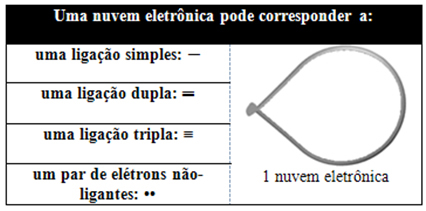
Помаже размишљање о овом облаку као о привезаном балону или балонима, са централним атомом у центру. На пример, у молекулу који има само два електронска облака око централног атома, већи могуће растојање између њих је угао од 180º и, сходно томе, геометрија молекула ће бити линеарне.
Дакле, можемо направити закључак о томе каква ће бити молекуларна геометрија већине молекула ако узмемо у обзир број атома у молекулима и везе које централни атом прави, проверавајући да ли има парове или не електрона.
Погледајте примере у наставку:
- Молекули са 2 атома: увек ће бити линеарне
На пример:
Х ─ Х, Х ─ Цл, Ф ─ Ф, О ═ О, Ц ≡ О.
Не заустављај се сада... Има више после реклама ;)
- 3-атомски молекул: угаоне или троугласте
ако је централни атом поседују пар невезујућих електрона геометрија ће бити угаона, као у случају СО молекула2:
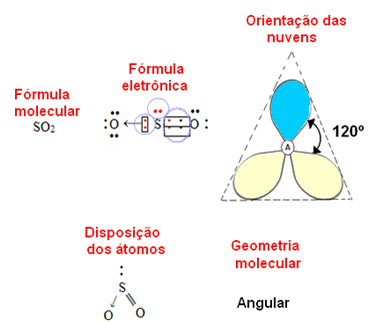
Сматрајте да плави електронски облак представља парове електрона који не учествују у везама, а жути да су парови електрона који учествују у везама.
- 4-атомски молекул: раван тригонална (или троугласта) или пирамидална (или тригонална пирамида)
Ако централни атом нема неупарени (невезујући) електронски пар, молекуларна геометрија је равна тригонална (или троугласта). Погледајте пример БФ3:

Ако атом има невезујуће електронске парове, геометрија молекула ће бити пирамидална (или тригонална пирамида), као у случају амонијака:

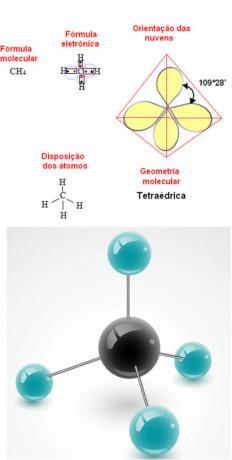
- 5-атомски молекул: тетраедарски
Пример геометрије метана:
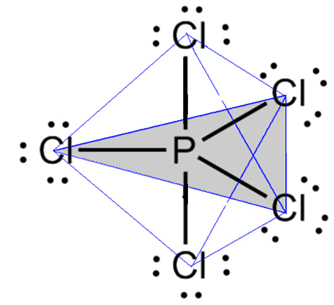
- Молекул са 6 атома: тригонална бипирамида или троугласта пирамида.
Пример је фосфор пентахлорид (ПЦл5), који има неке везе између фосфора и хлора под углом од 90º, а друге од 120º, формирајући бипирамиду са троугластом базом:
- 7-атомски молекул: октаедарски
Пример: сумпор хексафлуорид (СФ6), чији су углови 90º.

Аутор: Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
ФОГАЦА, Јеннифер Роцха Варгас. „Одређивање геометрије молекула“; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm. Приступљено 27. јула 2021.