Киселина је свака супстанца која јонизује у присуству воде и потиче, као један од јона, Х+ катјон. Киселине се могу класификовати према неколико критеријума, укључујући:
степен јонизације: је представљен симболом α и одговара односу између броја јонизујућих молекула и укупног броја растворених молекула. Пример: од сваких 100 растворених молекула ХЦл (хлороводоничне киселине), 92 молекула се подвргавају јонизацији.
Волатилност: овај критеријум класификује киселину у смислу њене лакоће преласка из течног у гасовито стање, могу бити испарљиве или фиксиране:
волатилес: већина киселина је испарљива. Пример: када отворимо флашу сирћета, убрзо приметимо његов карактеристичан мирис. То је зато што је сирћетна киселина присутна у сирћету веома испарљива киселина.
Фиксно: су мало испарљиве киселине, најчешћи пример је сумпорна киселина.
Сванте Аррехениус је био шведски хемичар који је 1887. извео бројне експерименте са супстанцама разблаженим у води и створио горњу дефиницију, па чак и дао нека запажања о киселинама:
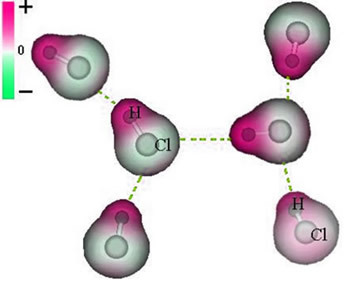
- Када су у воденом раствору, киселине проводе струју. То је зато што се киселине разлажу у јоне.
- Киселине јонизују у воденом раствору, односно дају јоне и катјон Х+.
- У реакцијама неутрализације киселине реагују са базама, формирајући соли и воду.
Остала својства киселина:
Реакција са металима: Киселине могу да реагују са многим металима, стварајући тако водоник (Х2) и со метала. Цинк и хлороводонична киселина реагују једна са другом, ова реакција се може представити једначином:
Не заустављај се сада... Има више после реклама ;)
Зн (с) + 2 ХЦл (ак) → ЗнЦл2 (ак) + Х2 (г)
Реакција са карбонатима и бикарбонатима: када реагује са киселинама, ањони изведени из карбоната (ЦО2-3-) и бикарбонати (ХЦО3-) ослобађају угљен-диоксид. Погледајте реакцију:
ЦаЦО3 (с) + 2 ХЦл (ак) → ЦаЦл2 (ак) + Х2О(1) + ЦО2 (г)
карбонат
од калцијума
Акција на индикаторе: Киселине мењају боју одређених супстанци које се називају индикатори, те мењају боју у зависности од тога да ли је медијум кисела или базна. Најчешћи индикатори су лакмус и фенолфталеин. Црвени раствор фенолфталеина постаје безбојан у присуству киселине. Плави лакмус папир постаје црвен.
Аутор: Лириа Алвес
Дипломирао хемију
Да ли бисте желели да референцирате овај текст у школском или академском раду? погледај:
СОУЗА, Лириа Алвес де. „Класификација и својства киселина“; Бразил школа. Доступна у: https://brasilescola.uol.com.br/quimica/classificacao-propriedades-dos-acidos.htm. Приступљено 27. јула 2021.