Органска хемија је широко подручје хемије која проучава једињења угљеника.
Знању из органске хемије приступа се на неколико начина и, размишљајући о томе, саставили смо вам предложене вежбе, пријемне испите и Енем питања да бисте проверили своје знање.
Такође користите коментаре резолуција да бисте сазнали још више о теми.
Предложене вежбе
Питање 1
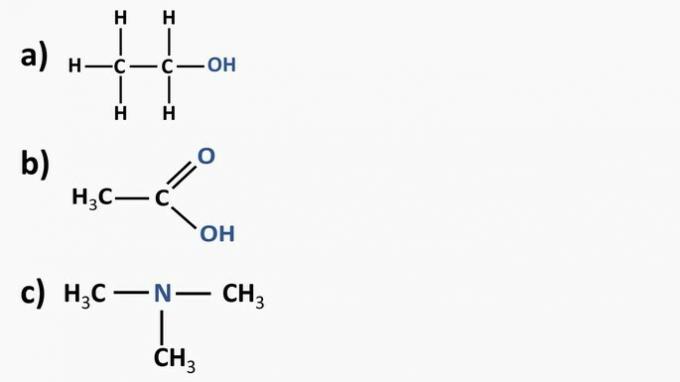
Погледајте органска једињења у наставку и идентификујте органске функције према истакнутим функционалним групама. После тога именовати супстанце.
Одговорити:
а) Органско једињење: етанол
- органска функција: алкохол
- Општа формула: Р — ОХ
- Идентификација: хидроксил (ОХ) повезан са ланцем угљеника
б) Органско једињење: етанска киселина.
- Органска функција: карбоксилна киселина
- Општа формула: Р — ЦООХ
- Идентификација: карбоксилни радикал (ЦООХ) повезан са ланцем угљеника
ц) Органско једињење: триметиламин
- Органска функција: амин (терцијар)
- Општа формула:
- Идентификација: азот повезан са три ланца угљеника
питање 2
У органској хемији, једињења се препознају по ланцима формираним од угљеника и водоника. Међутим, други елементи могу бити део хемијске структуре ових једињења, попут кисеоника.
Изаберите алтернативу где два органска једињења имају кисеоничне органске функције.
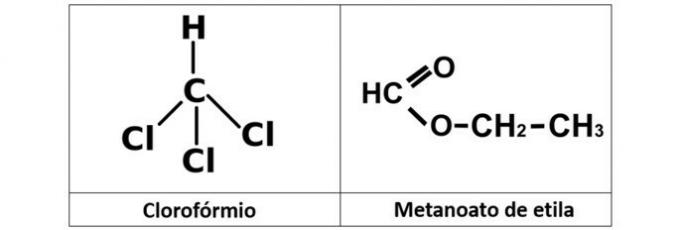
а) хлороформ и етил метанеат
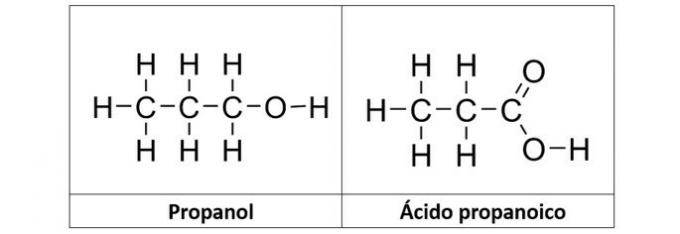
б) пропанол и пропанојска киселина
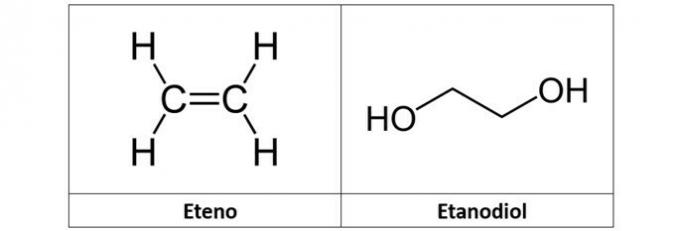
в) етен и етандиол
г) етанамид и бензен
Тачан одговор: б) пропанол и пропанојска киселина
а) ПОГРЕШНО. Имамо хлороформ (ЦХЦл3), који је алкил халогенид, и етил метаноат естар (Ц.3Х.6О.2), који у својој структури садржи кисеоник.
б) ТАЧНО. У овој алтернативи имамо два једињења која имају кисеоничне органске функције. Пропанол (Ц.3Х.8О) је алкохол који чине три угљеника. Пропанојска киселина (Ц.3Х.6О.2) је карбоксилна киселина.
в) ПОГРЕШНО. Етилен (Ц.2Х.4), који се такође назива етилен, је угљоводоник алкенског типа. Већ етандиол (Ц.2Х.6О.2) је алкохол са два хидроксила у својој структури.
г) ПОГРЕШНО. Етанамид (Ц.2Х.5НО) је амид, а бензен је ароматични угљоводоник и, према томе, настаје само од угљеника и водоника.

питање 3
Погледајте структуру органског једињења у наставку и проверите истините тврдње.

(01) Једињење има органску функцију азота.
(02) Примарни је амин, јер је везан само за један водоник.
(03) Назив једињења је диетиламин.
Прави одговор:
(01) ТАЧНО. Азотна органска функција присутна у једињењу је амин.
(02) ПОГРЕШНО. То је секундарни амин, јер је азот повезан са два ланца угљеника.
(03) ПОГРЕШНО. Име једињења је диметиламин, јер су за азот везана два метилна радикала.
питање 4
Еугенол, члан породице фенилпропаноида, је ароматично органско једињење присутно у каранфилићу, зачину који се користи од давнина.

Посматрајте структурну формулу једињења и идентификујте присутне органске функције.
а) Алкохол и етар
б) Фенол и етар
в) Алкохол и естар
г) фенол и естар
е) Алкохол и угљоводоници
Тачна алтернатива: б) Фенол и етар.
Еугенол у свом ланцу има кисеоничне органске функције, то јест, поред атома угљеника и водоника, и кисеоник је хетероатом.
Органску функцију фенола карактерише хидроксил (-ОХ) везан за ароматични прстен. У функцији етра, кисеоник се налази између два ланца угљеника.
питање 5
ЕДТА, чије је пуно име етилендиаминтетрасирћетна киселина, је органско једињење са многим применама. Његова способност везивања металних јона чини га хелатним агенсом који се широко користи у лабораторији и индустријски.
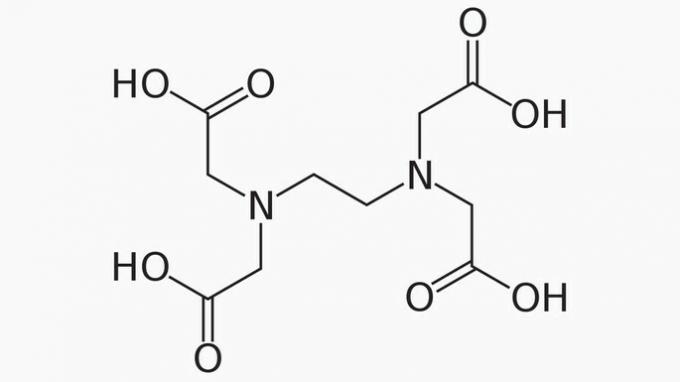
У вези са ЕДТА, тачно је рећи да је ланац угљеника:
а) Отворени, хомогени и незасићени.
б) Затворено, хетерогено и засићено.
в) Отворени, хетерогени и незасићени.
г) Затворено, хомогено и засићено.
д) Отворени, хетерогени и засићени.
Тачан одговор: е) Отворени, хетерогени и засићени.
Ланац ЕДТА класификован је на:
ОТВОРЕНО. Према распореду атома угљеника у структури ЕДТА, можемо видети да се, због присуства крајева, ланац једињења отвара.
ХЕТЕРОГЕНИ. Поред једињења угљеника и водоника, ланац угљеника има хетероатоме азота и кисеоника.
ЗАСИЦЕНО. Везе између атома угљеника су засићене, јер ланац има само једноструке везе.
Сазнајте више на: Органска хемија.
питања пријемног испита
Питање 1
(УФСЦ) Уочите непотпуне органске структуре и идентификујте тачне предмете:
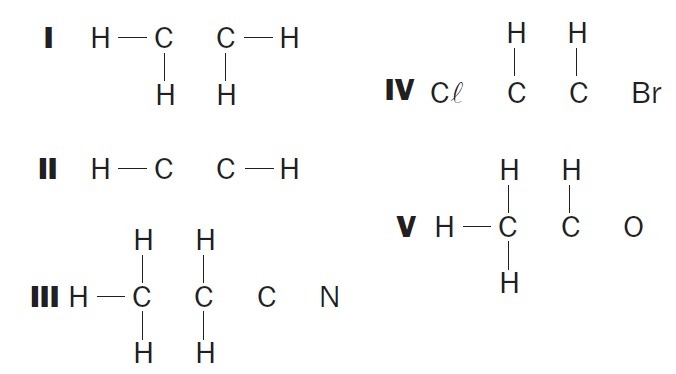
(01) Структури И недостаје једнострука веза између атома угљеника.
(02) У структури ИИ недостаје трострука веза између атома угљеника.
(03) Структури ИИИ недостају две једноструке везе између атома угљеника и трострука између атома угљеника и азота.
(04) Структури ИВ недостају две једноструке везе између атома угљеника и халогена и двострука веза између атома угљеника.
(05) У структури В недостаје једнострука веза између атома угљеника и једнострука веза између атома угљеника и кисеоника.
Тачне алтернативе: 02, 03 и 04.
Поред угљеника, обавезног хемијског елемента у органским једињењима, и други елементи могу бити присутни у структурама и повезани ковалентним везама, где се деле електрони.
Валентност елемената одређује број веза које се могу створити, као што је приказано у доњој табели.
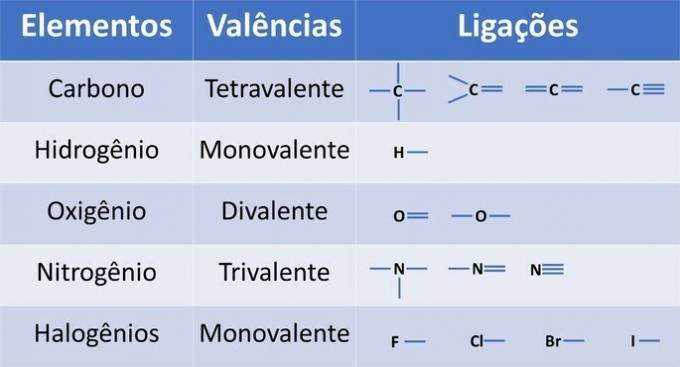
Из ових података имамо:
(01) ПОГРЕШНО. Структури недостаје двострука веза између атома угљеника да би се формирало етенско једињење.
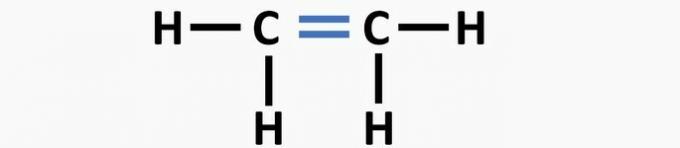
(02) ТАЧНО. Структури недостаје трострука веза између атома угљеника да би се формирало етинско једињење.
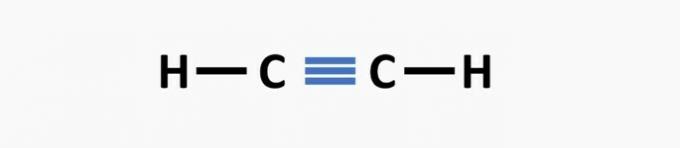
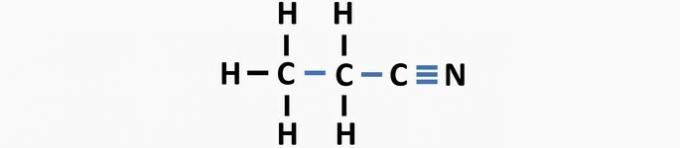
(03) ТАЧНО. У структури недостају једноструке везе између угљеника и троструке везе између угљеника и азота да би се формирало једињење пропаненитрил.
(04) ТАЧНО. У структури недостају једноструке везе између угљеника и халогена и двоструке везе између угљеника да би се формирало једињење дихлороетена.
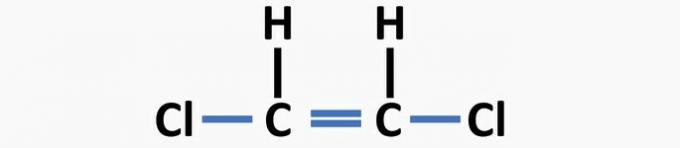
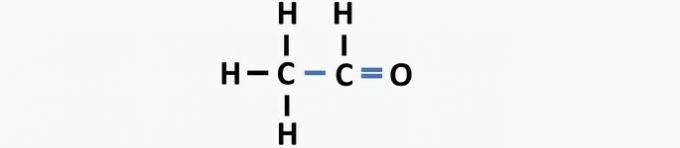
(05) ПОГРЕШНО. Структури недостаје једнострука веза између угљеника и двострука веза између угљеника и кисеоника да би се формирало етанско једињење.
питање 2
(УФПБ) Структура органског једињења молекулске формуле Ц.5Х.8Оно што представља разгранати, незасићени, хетерогени и алициклични ланац је:

Тачна алтернатива: д.
Угљенични ланци се могу класификовати на следећи начин:
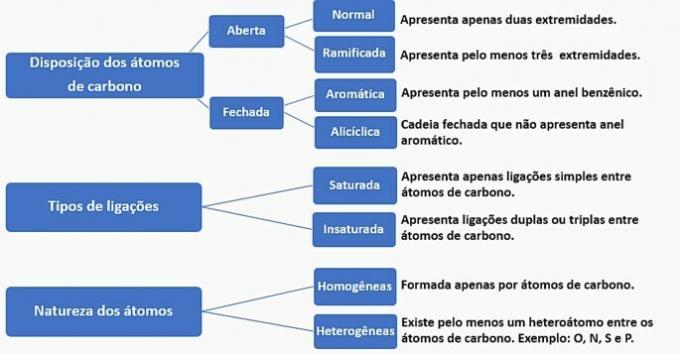
Према овим информацијама имамо:
а) ПОГРЕШНО. Ланац је класификован као нормалан, засићен, хомоген и алицикличан.
б) ПОГРЕШНО. Ланац је класификован као нормалан, незасићен, хомоген и отворен.
в) ПОГРЕШНО. Ланац је класификован као разгранат, незасићен, хомоген и отворен.
г) ТАЧНО. Ланац је класификован као разгранат, незасићен, хетероген и алицикличан
- Има грану: метилни радикал;
- Има незасићење: двострука веза између угљеника;
- Има хетероатом: кисеоник везан за два угљеника;
- Представља затворени ланац: угљеници повезани у круг без присуства ароматичног прстена.
е) ПОГРЕШНО. Ланац је класификован као разгранат, незасићен, хетероген и отворен.
питање 3
(Центец-БА) У доњој структури приказани бројеви угљеника су:
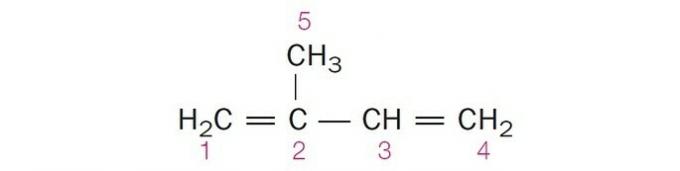
а) сп2, сп, сп2, сп2, сп3.
б) сп, сп3, сп2, сп, сп4.
ц) сп2, сп2, сп2, сп2, сп3.
д) сп2, сп, сп, сп2, сп3.
е) сп3, сп, сп2, сп3, сп4.
Тачна алтернатива: ц) сп2, сп2, сп2, сп2, сп3.
Будући да у валентној љусци има 4 електрона, угљеник је четверовалентан, односно има тенденцију да формира 4 ковалентне везе. Те обвезнице могу бити појединачне, двоструке или троструке.
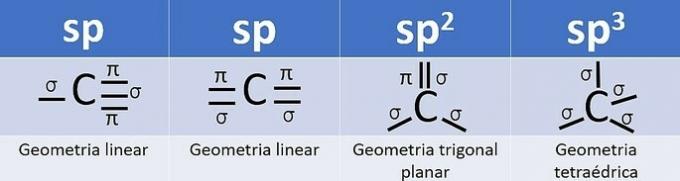
Број хибридних орбитала је збир сигма веза (σ) угљеника, пошто веза не хибридизује.
- сп: 2 сигма везе
- сп2: 3 сигма везе
- сп3: 4 сигма везе
Према овим информацијама имамо:
а) ПОГРЕШНО. Угљеник 2 има сп хибридизацију2, јер има 3 σ везе и једну везу .
б) ПОГРЕШНО. Угљеник нема сп хибридизацију4 а сп хибридизација се јавља када између угљеника постоји трострука веза или две двоструке везе.
в) ТАЧНО. Збир σ веза на сваком угљенику даје алтернативну хибридизацију.
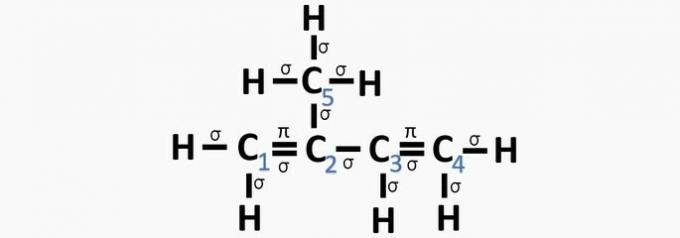
г) ПОГРЕШНО. Сп хибридизација се јавља када између угљеника постоји трострука веза или две двоструке везе.
е) ПОГРЕШНО. Угљеник нема сп хибридизацију4 а сп хибридизација се јавља када између угљеника постоји трострука веза или две двоструке везе.
питање 4
(УФФ) Постоји узорак гаса формиран од једног од следећих једињења: ЦХ4; Ц2Х.4; Ц2Х.6; Ц3Х.6 или Ц.3Х.8. Ако 22 г овог узорка заузима запремину од 24,6 Л под притиском од 0,5 атм и температуром од 27 ° Ц (дато: Р = 0,082 Л .атм. К.–1.мол–1), закључује се да је то гас:
а) етан.
б) метан.
в) пропан.
г) пропен.
д) етен.
Тачна алтернатива: в) пропан.
1. корак: претворите температурну јединицу из Целзијуса у Келвин.
2. корак: израчунајте број молова једињења помоћу опште једначине гаса.
3. корак: израчунати моларну масу једињења.
4. корак: пронађите угљоводоник који има моларну масу 44 г / мол.
Метан
Етхене
Етан
пропилен
Пропан
Стога се закључује да је гас који одговара информацијама у изјави пропан.
питање 5
(ИТА) Узмите у обзир следеће супстанце:
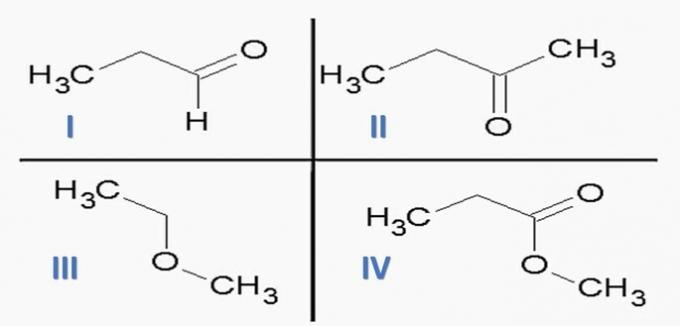
и следеће хемијске функције:
Тхе. карбоксилне киселине;
Б. алкохол;
ц. алдехид;
д. кетон;
и. естер;
ф. етер.
Опција која ТАЧНО повезује супстанце са хемијским функцијама је:
а) Ид; ИИц; ИИИе; ИВф.
б) Иц; ИИд; ИИИе; ПДВ
ц) Иц; ИИд; ИИИф; Ја сам.
д) Ид; ИИц; ИИИф; Ја сам.
е) Иа; ИИц; ИИИе; ИВд.
Тачна алтернатива: ц) Иц; ИИд; ИИИф; Ја сам.
Органске функције одређују структуре и групишу органска једињења са сличним карактеристикама.
Хемијске функције присутне у алтернативама су:
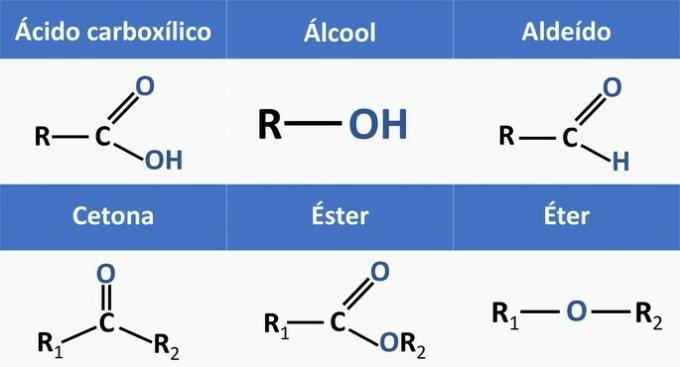
Анализирајући горње структуре и једињења присутна у изјави, имамо:
а) ПОГРЕШНО. Функције органа су тачне, али редослед је погрешан.
б) ПОГРЕШНО. Међу једињењима нема карбоксилне киселине.
в) ТАЧНО. Функционалне групе присутне у једињењима представљају следеће хемијске функције.

г) ПОГРЕШНО. И је алдехид, а ИИ је кетон.
е) ПОГРЕШНО. Међу једињењима нема карбоксилне киселине.
Сазнајте више на: Органске функције.
Енем питања
Питање 1
(Енем / 2014) Једна метода за одређивање садржаја етанола у бензину састоји се од мешања познатих количина воде и бензина у одређеној боци. Након мућкања боце и чекања одређеног временског периода, мере се запремине две фазе које се не мешају: једне органске и друге водене. Етанол, који се некада мешао са бензином, сада се може мешати са водом.
Да бисте објаснили понашање етанола пре и после додавања воде, потребно је знати
а) густина течности.
б) величину молекула.
в) тачка кључања течности.
г) атоми присутни у молекулима.
д) врста интеракције између молекула.
Тачна алтернатива: е) врста интеракције између молекула.
Интермолекуларне силе утичу на растворљивост органских једињења. Супстанце имају тенденцију да се растварају међусобно када имају исту интермолекуларну силу.
Погледајте у табели испод неке примере органских функција и врсту интеракције између молекула.
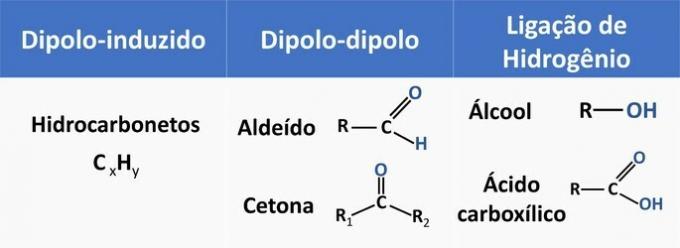
Етанол се сматра поларним растварачем, јер у својој структури има поларну групу (—ОХ). Међутим, његов ланац угљеника, који је неполаран (ЦХ), способан је за интеракцију са неполарним растварачима. Према томе, етанол се раствара и у води и у бензину.
Према овим информацијама имамо:
а) ПОГРЕШНО. Густина повезује масу тела са заузетом запремином.
б) ПОГРЕШНО. Величина молекула утиче на поларитет једињења: што је већи ланац угљеника, супстанца постаје неполарнија.
в) ПОГРЕШНО. Тачка кључања је корисна за одвајање молекула: дестилација раздваја једињења са различитим тачкама кључања. Што је нижа тачка кључања, молекул се лакше испарава.
г) ПОГРЕШНО. Алдехид у својој структури има угљеник, водоник и кисеоник. Ово једињење врши дипол-дипол интеракције, док алкохол, који има исте елементе, способан је да формира водоничне везе.
е) ТАЧНО. Интеракција етанола са водом (водонична веза) је интензивнија него са бензином (дипло-индукована).
питање 2
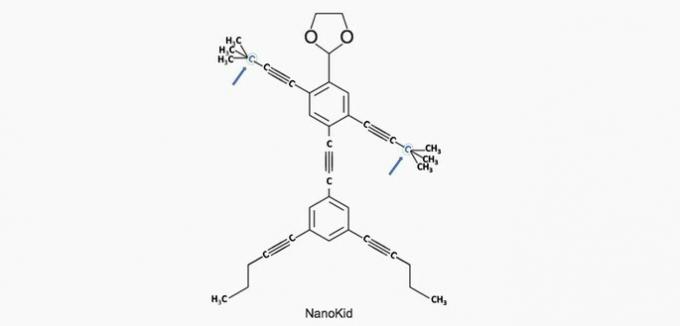
(Енем / 2013) Молекули нанопутани подсећају на људске фигуре и створене су да подстакну интересовање младих за разумевање језика израженог у структурним формулама, широко коришћеним у органској хемији. Пример је НаноКид, представљен на слици:
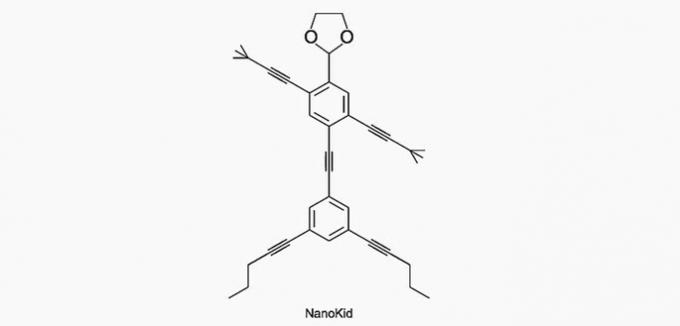
Где у телу НаноКида постоји кватерни угљеник?
а) Руке.
б) Глава.
в) Сандук.
г) Трбух.
е) Стопала.
Тачна алтернатива: а) Руке.
Угљеник се класификује на следећи начин:
- Примарно: везује се за угљеник;
- Секундарно: везује се за два угљеника;
- Терцијар: везује се за три угљеника;
- Квартар: везује се за четири угљеника.
Погледајте примере испод.

Према овим информацијама имамо:
а) ТАЧНО. Угљеник у руци везан је за четири друга угљеника, тако да је кватерни.
б) ПОГРЕШНО. Глава се састоји од примарних угљеника.
в) ПОГРЕШНО. Сандук се састоји од секундарних и терцијарних угљеника.
г) ПОГРЕШНО. Стомак се састоји од секундарних угљеника.
е) ПОГРЕШНО. Стопала се састоје од примарних угљеника.
питање 3
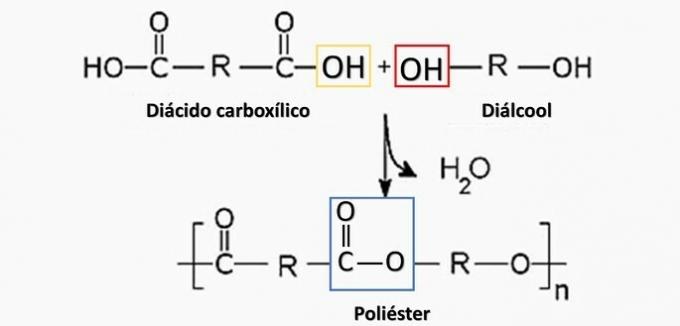
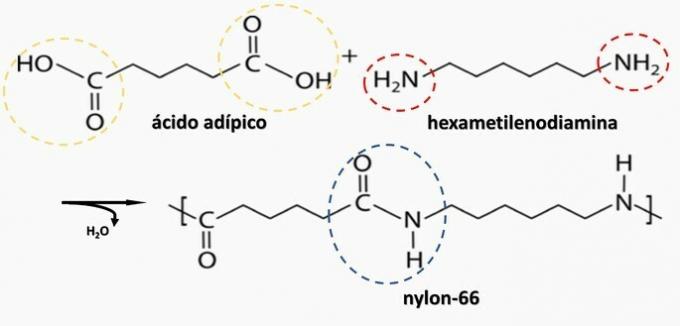
(Енем / 2014) Неки полимерни материјали не могу се користити за производњу одређених врста артефаката, било за ограничења механичких својстава, било лакоћом са којом пролазе кроз разградњу, стварајући за то непожељне нуспроизводе апликација. Стога инспекција постаје важна како би се утврдила природа полимера који се користи у производњи артефакта. Једна од могућих метода заснива се на разградњи полимера да би се произвели мономери који су до њега дошли.
Контролисано разлагање артефакта генерисаног диамином Х.2Н (ЦХ2)6НХ2 и ХО киселина2Ц (ЦХ2)4ЦО2Х. Стога је артефакт направљен од
а) полиестер.
б) полиамид.
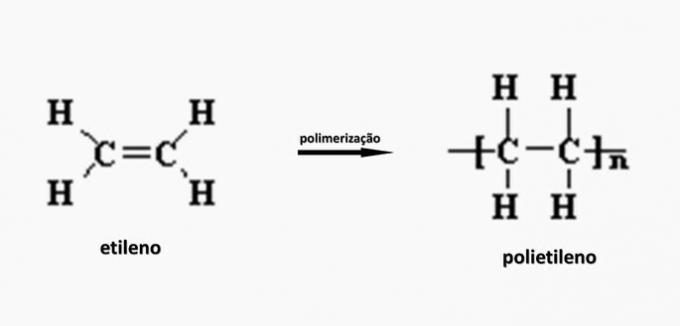
ц) полиетилен.
г) полиакрилат.
д) полипропилен.
Тачна алтернатива: б) полиамид.
а) ПОГРЕШНО. Полиестер настаје у реакцији између дикарбоксилне киселине (—ЦООХ) и диалкохола (—ОХ).
б) ТАЧНО. Полиамид настаје полимеризацијом дикарбоксилне киселине (—ЦООХ) са диамином (—НХ2).
в) ПОГРЕШНО. Полиетилен настаје у полимеризацији етилен мономера.
г) ПОГРЕШНО. Полиакрилат настаје сољу добијеном из карбоксилне киселине.
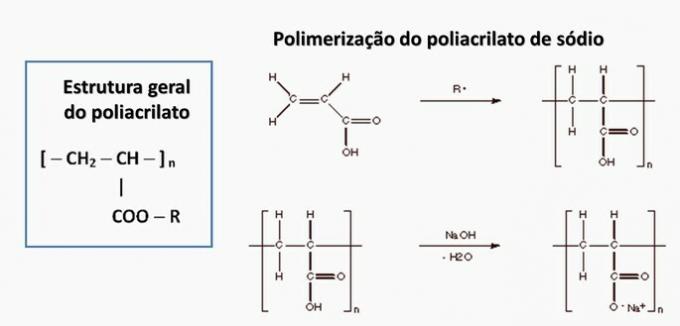
е) ПОГРЕШНО. Полипропилен настаје у полимеризацији пропиленског мономера.
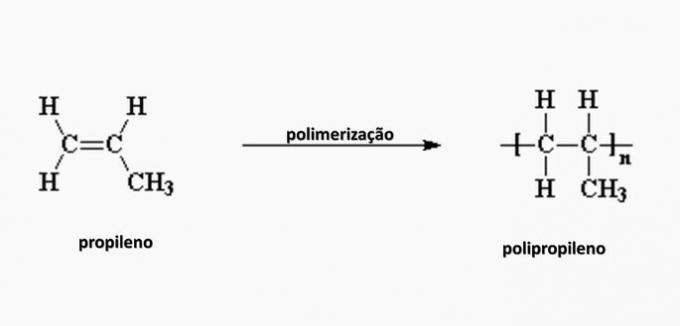
питање 4
(Енем / 2008) Кина се обавезала да ће обештетити Русију за просипање бензена из неке индустрије Кинеска петрохемикалија у реци Сонгхуа, притоци реке Амур, која чини део границе између њих две земље. Председник Федералне агенције за водне ресурсе Русије уверио је да бензен неће доћи до цевовода од пијаће воде, али је тражио од становништва да кључа текућу воду и избегава риболов у реци Амур и њеној притоке. Локалне власти складиште стотине тона угља, јер се минерал сматра ефикасним апсорбером бензена. Интернет: (са адаптацијама). Узимајући у обзир мере донете за смањење штете по животну средину и становништво, тачно је то констатовати
а) угаљ, кад се стави у воду, реагује са бензеном, елиминишући га.
б) бензен је испарљивији од воде и зато га треба прокувати.
в) оријентација на избегавање риболова је због потребе за очувањем рибе.
г) бензен не би контаминирао цеви за пијаћу воду, јер би се природно декантирао на дну реке.
е) загађење изазвано изливањем бензена у кинеској индустрији било би ограничено на реку Сонгхуа.
Тачна алтернатива: б) бензен је испарљивији од воде и зато је неопходно да се прокува.
а) ПОГРЕШНО. Угаљ садржи у својој структури неколико пора и користи се као адсорбент, јер је способан да комуницира са загађивачима и задржи их на својој површини, али не и да их елиминише.
б) ТАЧНО. Што је већа испарљивост неке супстанце, то се лакше претвара у гасовито стање. Док је тачка кључања воде 100 ° Ц, бензена 80,1 ° Ц. То је зато што је вода поларно једињење, а бензен неполарно једињење.
Тип интеракција које молекули стварају је различит и такође утиче на тачку кључања супстанци. Молекул воде је способан да створи водоничне везе, тип интеракције много јачи од оне коју бензен, са индукованим диполом, може да створи.
в) ПОГРЕШНО. У ланцу исхране, једно биће постаје храна другог, у складу са интеракцијама врста на локацији. Када се токсична супстанца пусти у животну средину, долази до прогресивног накупљања и рибе контаминирани, када их човек прогута, могу понети бензен са собом и изазвати мутације ДНК, па чак и чак и рак.
г) ПОГРЕШНО. Бензен има мању густину од воде. Дакле, тренд је да се и под водом наставља ширити.
е) ПОГРЕШНО. Сезонске промене могу додатно повећати проблем, јер ниске температуре смањују способност биолошког разлагања хемикалија деловањем сунца или бактерија.
питање 5
(Енем / 2019) Угљоводоници су органски молекули са низом индустријских примена. На пример, присутни су у великим количинама у разним нафтним фракцијама и обично се раздвајају фракционом дестилацијом на основу температуре кључања. У табели су представљене главне фракције добијене дестилацијом нафте у различитим температурним опсезима.
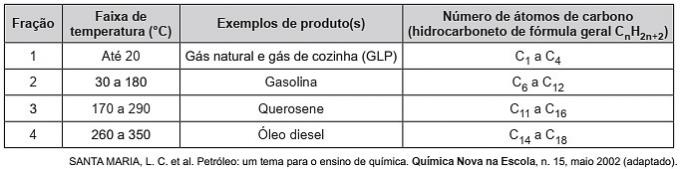
У фракцији 4 раздвајање једињења се дешава на вишим температурама јер
а) њихове густине су веће.
б) број грана је већи.
в) његова растворљивост у уљу је већа.
г) интермолекуларне силе су интензивније.
д) ланац угљеника је теже прекинути.
Тачна алтернатива: г) интермолекуларне силе су интензивније.
Угљоводоници интерагују индукованим диполом и ова врста интермолекуларне силе се појачава повећањем ланца угљеника.
Због тога теже нафтне фракције имају вишу температуру кључања, јер ланци јаче међусобно делују индукованим диполом.
За више вежби, са коментарисаном резолуцијом, такође погледајте:
- Вежбе на угљоводоницима
- Вежбе о органским функцијама
- Питања о хемији у Енем-у
