Може се догодити да постоје киселине истог елемента, а овај елемент има исти оксидациони број (НОКС), али разлика је у степенима хидратације.
На пример, доле имамо три киселине које формира елемент фосфор (П):
Х.3ДУСТ4 Х.4П.2О.7 ХПО3
Имајте на уму да је у све три киселине оксидациони број фосфора +5; разлика је у степену хидратације.
На основу овога, ове киселине се у номенклатури разликују преко префикса орто, пиро и мета.
Нај хидратизованија киселина назива се орто. У наведеном примеру, први (Х.3ДУСТ4) се зове киселина ортофосфорни, јер је најхидриранија од ове три. Ортонски префикс је потрошив, тако да ће се већина киселина најчешће позивати фосфорне киселине.
Префикси пиро и мета се користе са орто киселином као референтном тачком:
- Пирус: 2 молекула орто минус 1 молекул Х.2О.
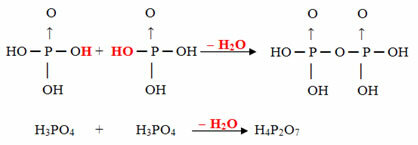
Пример: Х.4П.2О.7 се зове киселина пирофосфорни јер је једнака два молекула ортофосфорне киселине (Х3ДУСТ4) минус један молекул воде.
2. Х.3ДУСТ4 = Х6П.2О.8
Х.6П.2О.8 - Х2О = Х4П.2О.7
Овај процес је интермолекуларна дехидрација:
- Циљ: 1 молекул орто минус 1 молекул Х.2О.
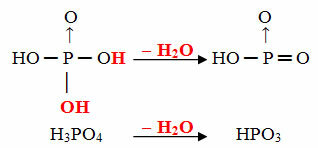
Пример: ХПО3 се зове киселина циљфосфорни јер је једнак молекулу ортофосфорне киселине (Х3ДУСТ4) минус један молекул воде.
Х.3ДУСТ4 - Х2О = ХПО3
Овај процес је интрамолекуларна дехидрација:
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm
