Површинско затезање је појава која се јавља на површини течности, попут воде, формирајући танак филм.
Када вода у течном стању заузме посуду, можемо да опазимо раздвајање течности и околине. То је зато што се интеракција између молекула воде на површини разликује од интеракције унутар течности.
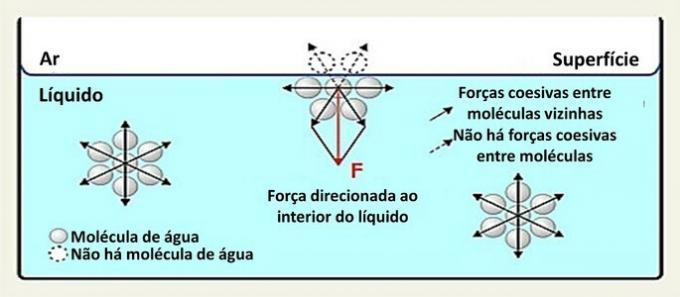
На површини, молекул воде комуницира са молекулима на бочним странама и испод ње. Унутра је молекул окружен другим молекулима и постоји интеракција у свим правцима кроз водоничне везе.
Управо због овог својства посматрамо феномен стварања капљице. Због овога је такође могуће да инсекти ходају по води.
Шта је површински напон?
То је стварање танког филма испод течности због неједнакости привлачности између молекула који га чине. Ова појава се израженије јавља код течности које имају Међумолекуларне снаге интензивно, попут воде.
Интеракције између врста у течности називају се кохезионим силама. Док молекуле унутар течности привлаче суседни молекули у свим правцима, молекули на површини делују са молекулима испод и поред њих.
Погледајте како се јавља површински напон у води.
Вода (Х.2О) је поларни молекул који чине 2 атома водоника (позитивни полови) и један атом кисеоника (негативни пол) који су спојени ковалентне везе. Позитивни пол молекула привлачи негативни пол суседног молекула, формирајући водоничне везе.
Ова врста интеракције унутар течности распоређена је у свим правцима. На површини су силе усмерене надоле и у страну, јер изнад њих нема молекула воде. То чини површинске молекуле кохезивније и ствара еластични филм.
Јединица површинског напона дата је количником између јединице силе и јединице дужине, при чему су највише усвојени дин / центиметар (дин / цм) и њутн / метар (Н / м).
Вода има висок површински напон чија је вредност 72,75 дина / цм. Међутим, жива, течни метал, има површински напон приближно 7 пута већи од воде, 475 дина / цм.
Желите да знате више? Дакле, погледајте следеће текстове:
- Својства воде
- Поларни и Аполарни молекули
- Хемијске везе
Појаве изазване површинским напоном
Површинска напетост одговорна је за неке појаве које уочавамо у свакодневном животу. Главни су:
Животиње које ходају по води

Инсекти, пауци и друге животиње могу ходати или се одмарати по Вода јер се на крајевима његових шапа налазе длаке обложене масном супстанцом и, према томе, не могу продрети између молекула воде који су спојени на површини.
Стварање капљица воде

Капљице воде су сферне због контракције у молекула површине узроковане површинским напоном. До сфере долази зато што је ово геометријски облик у којем постоји најмања веза између површине и запремине. Због тога сферни облик одржава најмањи број молекула воде у контакту са ваздухом.
Вежбе на површинском напону воде
1. Сурфактант је супстанца која делује на друго да би се променила:
а) Осмоларност.
б) Површински напон.
в) Електрофореза.
г) Вискозност.
д) Осмотски притисак.
Тачна алтернатива: б) Површински напон.
а) ПОГРЕШНО. Осмоларност је повезана са количином растворених честица које су садржане у датој запремини растварача.
б) ТАЧНО. И детерџенти и сапуни смањују површински напон воде и генерички се називају тензиди, јер су молекули ових материјала смештени између молекула воде и смањују напетост површно.
в) ПОГРЕШНО. Електрофореза је техника за одвајање молекула према њиховом набоју.
г) ПОГРЕШНО. Вискозност је физичко својство које одређује отпор течности да тече.
е) ПОГРЕШНО. Осмотски притисак је колигативно својство које одговара притиску који се мора вршити на систем да би се спречило да се осмоза догоди спонтано.
Сазнајте више о проблемима обухваћеним овим бројем:
- Својства материје
- Колигативна својства
- Осмотски притисак
2. Површински напон течности директно зависи од процеса интеракције између молекула, као што је на пример водонична веза. Која од супстанци у наставку има највећи површински напон?
а) бензен
б) октан
в) етил алкохол
г) угљен-тетрахлорид
д) етанска киселина
Тачна алтернатива: д) етанска киселина.
а) ПОГРЕШНО. Бензен је угљоводоник, неполарни молекул и не ствара водоничне везе.
б) ПОГРЕШНО. Октан је угљоводоник и, према томе, он је неполарни молекул који не ствара водоничне везе.
в) ПОГРЕШНО. Етил алкохол је мало поларно једињење које може да формира водоничне везе, али интеракција између молекула је ограничена.
г) ПОГРЕШНО. Угљен-тетрахлорид је неполарно органско једињење и зато не ствара водоничне везе.
е) ТАЧНО. Функционална група карбоксилне киселине (-ЦООХ) може да створи водоничне везе било са кисеоником, било са хидроксилним водоником.

Сазнајте више о проблемима обухваћеним овим бројем:
- Поларитет молекула
- Органске функције
- Угљоводоници
експеримент површинског напона
Погледајте видео испод са експериментом који показује површински напон воде.