Сублимација је промена из чврстог стања у гасовито и обрнуто, без проласка кроз течно стање.
Да би супстанца била подвргнута процесу сублимације, она мора бити подвргнута одређеним вредностима температуре и притиска.
Нафталин и ЦО2 чврста супстанца (суви лед) су примери супстанци које подлежу сублимацији у условима околине.

Дијаграм фаза
Физичко стање супстанце можемо открити познавањем вредности температуре и притиска којима је изложена.
За ово користимо дијаграме изграђене за сваку супстанцу на основу експерименталних вредности.
Назван "Дијаграм фаза“, подељен је на три региона који представљају чврста, течна и гасовита стања. Линије које ограничавају ове регионе сигнализирају тачке у којима супстанца мења фазу.
Трострука тачка на дијаграму означава температуру и притисак на којима супстанца може коегзистирати у три фазе. Испод ове тачке је кривуља сублимације.
Тачке на овој кривој одређују вредности притиска и температуре при којима ће доћи до сублимације.
Када се чврста супстанца подвргне притиску мањем од троструке тачке, ако се загреје, прећи ће директно у гасовито стање.
Промена из директног чврстог стања у гасовито може се десити и смањењем притиска када је његова температура нижа од температуре тројне тачке.
Сазнајте више на: Промене физичког стања.
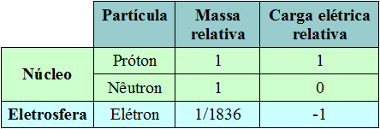
Дијаграм фазе угљен-диоксида (ЦО)2 )
Трострука тачка ЦО2 настаје када је притисак 5 атм. Ова чињеница оправдава уобичајену појаву сублимације у сувом леду, јер је притисак околине 1 атмосфера.
Из тог разлога течни угљен-диоксид се не добија у условима околине. У тим условима је или у чврстом стању или у парном стању.
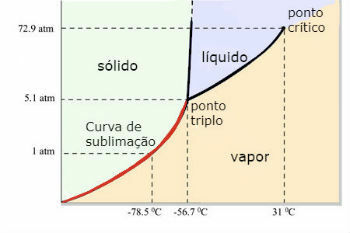
Дијаграм водене фазе (Х2О)
До троструке тачке воде долази када је притисак само 0,06 атм. Дакле, под амбијенталним условима није уобичајено да се вода сублимира.
Да бисте сазнали више, такође прочитајте:
- Физичка стања воде
- Физичка стања материје
- Укапљивање или кондензација
- Својства материје
- Солидифицатион
- Фузија
- Испаравање
- Врење
- Испаравање