Атоми су бескрајно мале честице које чине сву материју у универзуму. Временом се идеја о томе каква би била атомска структура променила према новим открићима научника. О овоме можете сазнати више у текстуЕволуција атомског модела.
Модел је приказ стварности (а не сама стварност), па су атомски модели представе главне компоненте атома и његову структуру и објашњавају одређена физичка и хемијска понашања материје. То је учињено јер још увек није могуће да људско биће види изоловани атом чак и са ултрамикроскопима.
Да бисте добили идеју о томе колико је мали атом, знајте то Тхе Најмања честица видљива под обичним микроскопом садржи преко десет милијарди атома! Атом је толико мали да, ако их ставимо милион раме уз раме, не бисмо стигли до дебљина длаке.
Мапа ума: Атом
* Да бисте преузели мапу ума у ПДФ-у, Кликните овде!
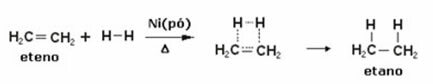
Међу атомским моделима, који се тренутно користи у средњој школи за разумевање структуре атома и његових својстава је Рутхерфорд-Бохр-ов модел. Према овом моделу, структура атома састоји се од два главна дела: језгро и електросфера.

Два главна дела структуре атома - електросфера и језгро
* Језгро: Састављен као централни део атома, компактан је, масиван и врло густ, поред тога што га чине честице веће масе, а то су протони и неутрони.

Илустрација протона и неутрона који чине атомско језгро
- протони: то су честице са позитивним електричним набојем (релативни набој = +1; наелектрисање у кулону (Ц) = +1,602. 10-19) и његова релативна маса је једнака 1.
Чињеница да протони чине језгро и дају му укупан позитиван набој открила је Еуген Голдстеин, 1886. кроз модификацију Цроокесове ампуле и неке експерименте. Видео је да се под врло високим напонима појављују емисије (анодни зраци - остаци атома гаса који су били унутар сијалице и којима је електрично пражњење откинуло електроне). Постављањем електричног или магнетног поља изван сијалице, ови зраци су скренути ка негативном полу. То је значило да постоје позитивне субатомске честице, које су назване протони.
Касније, Ернест Рутхерфорд (1871-1937) извели експеримент описан у тексту Рутхерфордов Атом, што га је довело до откривања локације протона: у језгру.
- Неутрони: то су честице са масом једнаком маси протона (1), али као што назив говори, они су неутрални, односно немају електрични набој.
Неутрони су откривени 1932 Јамес Цхадвицк (1891-1974), који су схватили да језгро радиоактивног берилијума емитује неутралне честице са масом отприлике једнаком маси протона (у ствари је нешто већа).
Не заустављај се сада... После оглашавања има још;)
Пречник језгра зависи од количине протона и неутрона које има атом, али је у просеку око 10-14 10. месец-15 м.
Атомско језгро концентрише практично целокупну масу атома, чинећи га врло малим делом: и протон и неутрон су око 100.000 пута мањи од самог атома! Поређења ради, замислите да повећавамо језгро атома елемента водоник (који има само протона) до величине тениске лоптице, најближи електрон био би удаљен око три километра удаљеност! Чак и када би атом био увећан до висине 14-спратне зграде, његово језгро би било величине пуког зрна соли на седмом спрату. То је заиста нешто невероватно, зар не мислите ?!
* Електросфера: Је регион у коме се електрони ротирају око језгра. Иако је регион много веће запремине од језгра, он је практично празан, јер је сваки електрон 1836 пута мањи од 1 протона (или од 1 неутрона). Због тога је маса атома практично сва у језгру. Електрони су честице са негативним електричним набојем (-1).
Електрони су откривени 1897 Јосепх Јохн Тхомсон (1856-1940), творац Тхомсон-ов атомски модел. У тексту се детаљно може видети Томсонов експеримент Томсонов експеримент са електричним пражњењем, али укратко, употребио је поменуту Цроокес ампулу и схватио да су катодни зраци увек привучен позитивним полом, који је доказао да атом има негативне честице, које су назване електрони.
Електрони се врте око језгра милијардама пута у милионитом делу секунде, обликујући атом и чинећи да се понаша као да је чврст.
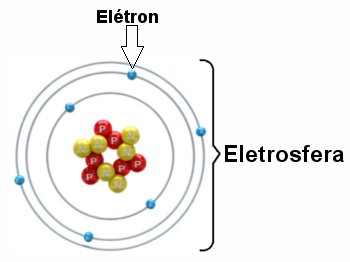
Илустрација електросфере са три електронска слоја и електронима који се окрећу око језгра.
Укратко, можемо направити табелу како бисмо разликовали три главне субатомске честице које су део структуре атома:

Маса и електрични набој три главне субатомске честице - протона, неутрона и електрона
Атоми свих хемијских елемената састоје се од ове три субатомске честице. Оно што разликује један хемијски елемент од другог је количина у којој се ове честице појављују, посебно количина протона у језгру, која се назива атомски број. Наставите да о томе проучавате кроз текст. Хемијски елемент.
* Моја ментална мапа, Диого Лопес
Јеннифер Фогаца
Дипломирао хемију
Хемија
Класификација материје, воде, цијановодоничног гаса, угљен-диоксида, амонијака, водоника, хелијума, супстанци једноставне, сложене супстанце, смеше, фазе смеше, хомогена смеша, смеша хетероген.