Хлориди су она јонска једињења која садрже анион Цℓ-1.
Хлор је из породице 17 или 7А, његов атомски број је једнак 17 и има 7 електрона у валентној љусци (најудаљенијој електронској овојници атома). Према правило октета, да би била стабилна, мора да има 8 електрона у овој последњој љусци и зато треба да прими још један електрон. Када се то догоди, односно када прими електрон, уопште, из јонске везе са металом, формира се а.нион хлорид (Цℓ-1), метал који је одустао од електрона постаје катион, а настала супстанца је јонска.
Хлориди су соли добијене реакцијом базе са хлороводоничном киселином (ХЦℓ(овде)). База даје катион, а хлороводонична киселина даје хлоридни јон:
Генеричка база + хлороводонична киселина → Хлорид + вода
ЦОХ + ХЦℓ → ЦЦℓ + Х2О.
Сви хлориди су класификовани као анорганске соли, јер у воденом медијуму ослобађају катион који није Х.+ и ослобађају хлоридни анион, а не хидроксил (ОХ-).
Номенклатура хлорида се увек придржава овог правила: Хлорид +де + (назив елемента повезаног са хлором).
У ваше формуле се формирају замењујући јонске набоје за индексе (број који се налази у доњем десном углу симбола елемента, означавајући број атома тог елемента који су присутни и праве везе).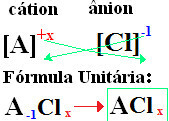
ако индекс је "1", не треба да га уписујете у формулу, као што је приказано доле:
У+1 Цℓ-1 → У1Цℓ1 → УЦℓ: натријум хлорид;
К.+1 Цℓ-1 → КЦℓ: калијум хлорид;
Ево+2 Цℓ-1→ЦаЦℓ2: калцијум хлорид;
Ба+2 Цℓ-1→ Бовде2: баријум хлорид;
Аℓ+3 Цℓ-1→АЦℓ3: алуминијум хлорид.
Међутим, како је објашњено у тексту „Јонске супстанце из групе: хлорид, карбонат, нитрат и сулфат”, Као и код свих јонских супстанци, хлориди немају своје јединствене формуле изоловане у природи, јер се њихови јони међусобно привлаче и чине кристалне решетке.
Главни пример хлорида који имамо у свакодневном животу је натријум хлорид, НаЦℓ, кухињска со. Погледајте јонску везу која резултира њеним стварањем (у којој натријум донира електрон хлору) и испод кристалне решетке ове соли:
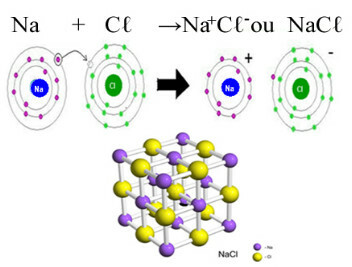
У кристалној решетки натријум хлорида сваки анион Цℓ- је окружен са 6 катиона На+ и обрнуто, па је координациони број ове кристалне решетке 6.
Сви хлориди су чврсте материје у амбијенталним условима и сасвим растворљив у води, спадајући међу најчешће соли које се налазе у нашем свакодневном животу, с обзиром на то да их има неколико присутни су растворени у минералној води, води за пиће, водоводној води, рекама, морима други. Међу изузецима, као што су нерастворљиви у води хлориди, су среброхлорид (АгЦℓ - приказан на доњој слици), из једињења олова, бакра и живе.

Сребрни хлорид нерастворљив у води *
Јони Цℓ-1 из хлорида које уносимо, углавном у сол, риба и месо, важни су за неке функције људског тела, јер су главни ванћелијски анион, присутни у соку желудац, регулишу телесне течности, као што је расподела воде у телу, и одржавају осмотски притисак и неутралност плазме електрични.
Његов недостатак може изазвати анксиозност, дијареју и проблеме са циркулацијом. Његов вишак се излучује урином (у просеку свака особа дневно излучи око 4 г хлорида), знојем и фецесом.
*Имаге Цредит: Аутор: Данни С. / Слика извучена из: Викимедиа Цоммонс
Јеннифер Фогаца
Дипломирао хемију
