О. амонијум нитрат је чврста супстанца молекулске формуле НХ4АТ ТХЕ3 и бели изглед (када је чист). конституисан од јони НХ4+ (амонијум) и НО3- (нитрата), није запаљив, али је врло оксидирајући и реактиван. Његова реакција разградње генерише велику количину гасова као производ, што неодговарајуће складиштење овог производа чини озбиљним проблемом, јер може доћи до експлозија. И такође широко се користи у пољопривреди као ђубриво.
Прочитајте такође: Природне супстанце - молекули пореклом из природе
Шта је амонијум нитрат?

Амонијум нитрат то је сол коју чине јони НХ4+ (амонијум) и НО3- (нитрат). То је чврсто једињење које, кад је чист, беле је боје. Широко се користи као пољопривредно ђубриво, али се такође може користити у производњи експлозива, као то је врло оксидирајућа супстанца, затим оксидира. Реакција одбегавања амонијевог нитрата генерише велико ослобађање гасови, изазивајући експлозивни удар.
Не заустављај се сада... После оглашавања има још;)
Карактеристике амонијум нитрата
Моларна маса: 80,04336 г / мол.
Сол састављена од јона: амонијум (НХ4+) и нитрата (БР3-).
Изглед: бела чврста супстанца.
Снажно је оксидира.
Лако реагује са другим супстанцама.
Није запаљив.
За нормалне услове температуре и притиска:
- густина: 1,73 г / цм3;
- тачка кључања: 210 ° Ц;
- тачка топљења: 169,6 ° Ц;
- степен растворљивости у води: 216 г / 100 мл;
- пХ: 5,5 (0,2 М).
Формула амонијум нитрата
Молекулска формула овог једињења је НХ4АТ ТХЕ3.

Разградња амонијум нитрата
јер је а супстанца високе реактивности и високог оксидационог потенцијала, амонијум нитрат, подвргнут високој температури, покреће а реакција разлагања, а главни производи су гасови, азот, кисеоник и водене паре. Разлагање се даје у два корака:
→ 1. корак:
2НХ4АТ ТХЕ3 (с) → 2Н2О (г) + 4Х2О (г)
→ 2. фаза:
2Н2О → 2Н2(г) + О.2(г)
→ Глобална једначина:
2НХ4АТ ТХЕ3 (с) → 2Н2(г) + О.2(г) + 4Х2О (г)
Приметите да је у првој једначиниједан од производа добијена разградњом је азот-оксид (Н.2О), такође познат као гас смејавац. Користи се за повећање снаге аутомобилских мотора да сагоревају гориво и као анестетик, углавном стоматолози. То је такође један од главних гасова одговорних за ефекат стаклене баште.
Погледајте такође: Које су врсте хемијских реакција?
Производња амонијум нитрата
Амонијум нитрат се може добити помоћу реакција између амонијум сулфата (НХ4)2САМО4 и калцијум нитрат Ца (НО3)2. Види доле:
(НХ4)2САМО4 + Ца (БР3)2 → 2 НХ4АТ ТХЕ3+ Цасе4
Такође се може добити од гасовитог амонијака, који се мехури у раствору азотне киселине, имајући као производ реакције водени амонијум нитрат. Погледајте:
НХ3 (г) + ХНО3 (ак) → НХ4АТ ТХЕ3(овде)
Употреба амонијум нитрата

- Производња ђубрива
- Експлозиви у рудницима, каменоломима и грађевинарству
- Хербициди и инсектициди
- Добијање азот-оксида за индустријску примену
- Апсорбенти за оксиде
- Оксиданс за ракетна горива
- Производња изотермних врећа
- Производња анестетичког дима за управљање кошницама у пчеларству
Такође приступите: Како се борити са ватром?
Опасности од амонијум-нитрата
Један од главних ризика повезаних са амонијум нитратом је у неадекватно складиштење. Пошто је врло оксидирајућа супстанца и реагује са неколико других једињења, покреће а реакција са ослобађањем велике запремине гаса. Неправилно складиштење подложно је контаминацији запаљивим производима, излагању топлоти или задржавању гасова, шта може изазвати експлозије.
То се, на пример, већ догодило у Тексасу, у Сједињеним Државама, са теретним бродом који је дошао из Француске и превозио 2.086 тона амонијум нитрата. догодила се несрећа 1947. године и постао познат као Тексашка градска катастрофа. Трагедија је проузроковала смрт 581 особе а догодио се услед пожара који није био у броду и који је стигао до амонијум терета, што је изазвало експлозију.
Други пример је био секвенца експлозије што се догодило 4. августа 2020. у луци град Бејрут, Либан, оставивши више од 100 људи мртвих и 5.000 рањених. Величина експлозије настала је услед паљења ланчане реакције тамо нагомиланог 2.750 тона пуњења амонијум нитрата.
Такође је вредно напоменути да амонијум нитрат може изазвати иритација коже и очију и ако се удише, проблема са дисањем. У крвотоку супстанца има токсичну моћ, јер реагује са телесним течностима, а производи ове реакције, попут нитрата, могу нанети штету здрављу, попут болест плаве бебе, такође позната као инфантилна метхемоглобинемија (низак хемоглобин у крви). Ова болест се понавља у породицама у руралним областима због контаминације амонијум нитрата, присутног у ђубривима, водених тела у пољопривредном региону.
аутор Лаиса Бернардес
Наставник хемије
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
АРАуЈО, Лаиса Бернардес Маркуес де. "Амонијум нитрат"; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm. Приступљено 27. јуна 2021.
Биологија
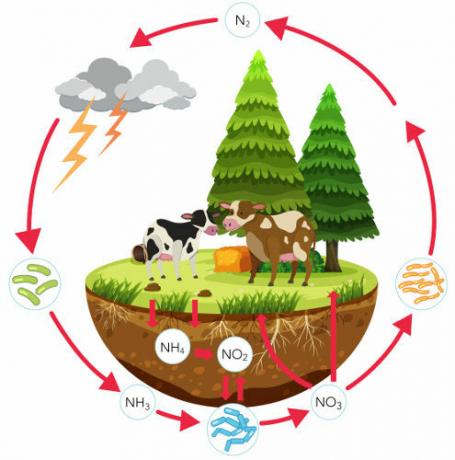
Сазнајте више о циклусу азота, важном биогеокемијском циклусу који обезбеђује циркулацију овог елемента. У овом тексту ћемо се позабавити сваким кораком азотног циклуса, разговарати о његовом значају и усредсредити се на улогу бактерија у овом процесу. Такође ћемо представити вежбе на ту тему.