Изомеризам то је природни феномен у којем различите супстанце (у погледу хемијских и физичких својстава) имају потпуно исту молекулску формулу, као у следећем примеру:
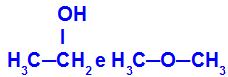
Различите супстанце које имају исту молекулску формулу
Етанол (лево) има молекулску формулу Ц.2Х.6О, што се јавља и код метоксиетана (десно), па су они изомери.
Врсте изомеризма
→ равни изомер
Тип изомерије је тај који проучава структурне разлике између изомера.
Тхе) Занимање
То је врста равне изомерије у којој се разлика између супстанци заснива на разлици између органских функција којима припадају. Погледајте неке примере:
Пропанон и пропан:
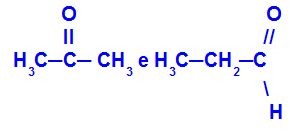
Изомери који припадају различитим функцијама
Пропанон (лево) припада кетонској групи, а пропанал (десно) алдехидној групи.
Б) Затвор
То је врста равне изомерије у којој се разлика између супстанци заснива на разлици између ланаца које представљају. Погледајте пример:
2-метил-пропан и бутан
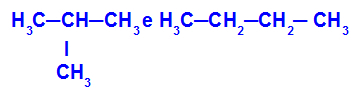
Изомери који имају ланце са различитим класификацијама
У примеру можемо видети да 2-метил-пропан (лево) има разгранат ланац, а бутан (десно) нормалан ланац.
ц) Положај
То је врста равне изомерије у којој се разлика између супстанци заснива на разлици у положају компоненте која је присутна у њиховим ланцима. Погледајте пример:
1-хлоро-пропан и 2-хлоро-пропан
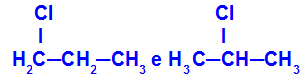
Изомери који имају компоненте на различитим положајима у ланцу
У примеру можемо видети да 1-хлоро-пропан (лево) има хлор позициониран на угљенику 1, а 2-хлоро-пропан (десно) хлор позициониран на угљенику 2.
д) Метамерија или компензација
БЕЛЕШКА: Изомерија која важи искључиво за хетерогене жице.
То је врста равне изомерије у којој се разлика између супстанци заснива на разлици у положају хетероатома који је присутан у њиховим ланцима. Погледајте пример:
Пример: Метоксипропан и етоксиетан
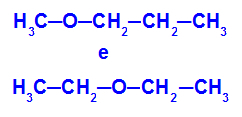
Изомери који имају хетероатоме на различитим положајима у ланцу
У примеру можемо видети да у метоксипропану (лево) кисеоник има радикал са једним угљеником на једној и три угљеника с друге стране. У етоксиетану (десно) кисеоник има радикал са два угљеника на једној и два угљеника на другој страни.
и)Таутомерија
То је посебан случај изомерије равних функција и јавља се у само три органске функције:
Алдехид
кетон
Енол
Ова врста изомерије делује на чињеницу да постоји хемијска равнотежа између енола и алдехида и између енола и кетона, односно ове компоненте се непрестано претварају једна у другу. Погледајте пример:
Проп-2-ен-1-ол и пропанон
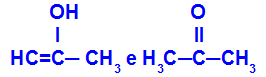
Изомери који припадају различитим функцијама
У примеру можемо видети да Проп-2-ен-1-ол (лево) припада групи енола, а пропанон (десно) групи кетона, па су изомери таутомерије.
→ Свемирска изомерија
То је врста изомерије дефинисана просторном анализом молекула.
а) Геометријски изомери
Не заустављај се сада... После оглашавања има још;)
То је врста просторне изомерије која се јавља када супстанца има молекуле са следећим карактеристикама:
Затворени ланац који има два угљеника са два различита лиганда, као у примеру доле:

Затворена структура са геометријском изомеријом
Отворени ланац који има двоструку везу између угљеника и у сваком од ових угљеника двоструке везе постоје два различита лиганда, као у доњем примеру:
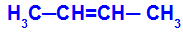
Отворена структура са геометријском изомеријом
Геометријска изомерија је подељена у две групе:
1О. Група: цис-транс
То се дешава када су два лиганда једног угљеника строго једнака два лиганда другог угљеника, било у отвореној структури или у затвореној структури.
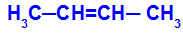
Ланац супстанце која има цис-транс изомерију
Изомер ће се звати цис када су исти лиганди у истој равни.

Пример цис изомера
Изомер ће се звати транс када су различити лиганди у истој равни.

Пример транс изомера
2О. Група: Е-З
Појављује се када су два лиганда једног угљеника различита у односу на два лиганда другог угљеника, било у отвореној структури или у затвореној структури.

Ланац супстанце која има Е-З изомеризам
Изомер ће се звати Е када су лиганди са највећим атомским бројем у супротним равни. У примеру испод, угљеник лево има Бр са највећим атомским бројем (35), а у другом је кисеоник (8).
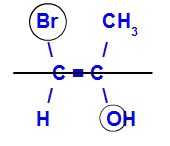
Пример Е-изомера
Изомер ће се звати З када су лиганди са највећим атомским бројем у истој равни. У примеру испод, угљеник лево има Бр са највећим атомским бројем (35), а у другом је кисеоник (8).

Пример З-изомера
Б) оптички изомер
То је врста просторне изомерије која се јавља само ако супстанца има молекуле са хирални угљеник (онај који има четири различита лиганда) у својим структурама. Молекул са хиралним угљеником има способност поларизације и одбијања светлости, како следи:
Десно (десни изомер)
Лево (леворотациони изомер)
Једињење са оптичком активношћу увек има активни изомери (звани оптички антиподи) и неактивни изомери (смеша између два активна изомера, смеша која се назива рацемична).
Следећу формулу можемо користити за одређивање броја активних (ИОА) и неактивних (ИОИ) изомера једињења које има хирални угљеник:
ИОА = 2не
ИОИ = 2не
2
Испод је пример једињења које има геометријску изомерију:
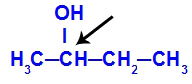
Хирални угљеник садржан у бутан-2-олу
Структура бутан-2-ола има следеће лиганде:
Метил (ЦХ3)
Етил (ЦХ3-ЦХ2)
Водоник (Х)
Хидроксил (ОХ)
Будући да има само један хирални угљеник, бутан-2-ол има:
Активни изомери:
ИОА = 21
ИОА = 2
Неактивни изомери:
ИОИ = 21
2
ИОИ = 2
2
ИОИ = 1
Ја сам, Диого Лопес Диас
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ДАНИ, Диого Лопес. „Шта је изомерија?“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Приступљено 27. јуна 2021.


