У органске реакције елиминације су они код којих се атоми или групе атома молекула уклањају или уклањају из њега, стварајући ново органско једињење, поред неорганског једињења које настаје делом који је био избрисан.
Једна врста реакције елиминације је дехидратација, у којем је молекул који се губи вода. Дехидрација алкохола (једињења која имају ОХ групу везану за засићени угљеник у отвореном ланцу) може се одвијати на два начина: интрамолекуларни и интермолекуларни.
„Интра“ значи „унутра“, дакле, интрамолекуларна дехидрација алкохола се дешава када молекул воде излази из „саме унутрашњости“ самог молекула алкохола. У овом случају, формирани органски производ биће алкен.
Ова реакција се одвија само у присуству катализатора који делује као средство за сушење и већину времена је концентрована сумпорна киселина (Х2САМО4), а температура треба да буде око 170ºЦ.
Пример:
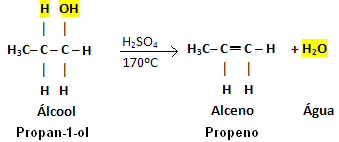
Имајте на уму да је ОХ група напустила, а водоник напустио суседни угљеник, дајући воду. Даље, створена је двострука веза која је довела до алкена.
Објекат који трпи дехидрацију следи следећи опадајући редослед:
Терцијарни алкохоли> Секундарни алкохоли> Примарни алкохоли
Али шта када ОХ група дође у средину угљеничног ланца? Атом водоника из којег ће се ослободити суседни атом угљеника и формирати молекул воде?
Не заустављај се сада... После оглашавања има још;)
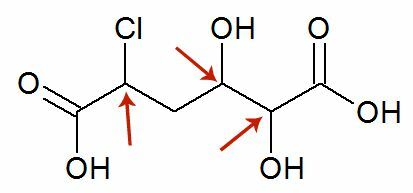
На пример, следећи је 2-метилпентан-3-ол. Имајте на уму да је један суседни атом угљеника терцијарни (означен црвеном бојом), док је други секундарни (истакнут плавом бојом):
Х ОХ Х
│ │ │
Х.3Ц─ Ц ─ Ц ─ Ц ЦХ3
│ │ │
Х Х ЦХ3
Водоник везан за терцијарни атом угљеника биће лакше напустити, јер је његов електронегативни карактер једнак δ+1Дакле, што је карактер угљеника мање негативан, то ће веза између њих бити слабија и биће лакше раскинути њихову везу.
У оваквим случајевима настају сва могућа једињења, али превласт ће бити дата редом: Терцијарни алкохоли> Секундарни алкохоли> Примарни алкохоли.
Тако имамо:
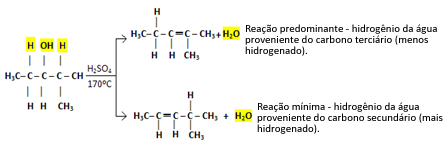
Ова врста реакције се покорава Сајцефово правило, који то говори биће већа тенденција да водоник оставља угљеник мање хидрогенизован. Ово правило је управо супротно од Правило Марковникова користи се за реакције додавања.
Да бисте употпунили своје знање о овој теми, прочитајте и текст "Интермолекуларна дехидрација алкохола”.
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Интрамолекуларна дехидрација алкохола“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm. Приступљено 28. јуна 2021.