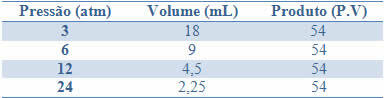
У овом тексту ћемо видети како а графикон промена физичког стања било чиста супстанца, како протумачити ову врсту дијаграма и како је представљен графикон смеша.
За ово, размотримо пример воде. Замислите да узмемо чашу леда на температури од –10 ºЦ и започнемо процес грејања под притиском од 1 атм. Како се температура повећава, од -10 ºЦ до -9 ºЦ, до -8ºЦ и тако даље, лед ће остати у чврстом стању док не достигне температуру од 0 ºЦ.
У том тренутку почиње да прелази у течно стање, односно почиње да се одвија фузија. Температура неће наставити да расте као раније, већ ће остати константна на 0 ° Ц док се сав лед не отопи:

Након топљења све чврсте супстанце, температура система ће се повећавати све док температура не достигне 100 ° Ц. На овој температури вода која је била у течном стању почеће да се мења у парно стање, односно кључаће.
Баш као што се то догодило у тачка фузије, на тачки кључања, температура ће такође остати константна све док се сва течност не претвори у пару. Након тога, ако наставимо да грејемо систем, температура ће и даље расти:

Спремни! Ово је графикон или дијаграм који представља промену физичког стања воде или њене криве грејања. Да је у питању инверзни процес, имали бисмо следећу криву воденог хлађења:

Веома важан аспект ових графикона је да их чине два нивоа, односно постоје две тачке у којима температура неко време остаје константна. То се увек дешава код промене стања чисте супстанце. Једина разлика су вредности тачке топљења и кључања.
Не заустављај се сада... После оглашавања има још;)
На пример, кисеоник, за разлику од воде, није течност, већ гас на собној температури (око 20ºЦ). То је зато што је његова тачка топљења на нивоу мора -223,0 ° Ц, а тачка кључања -183,0 ° Ц. Погледајте графикон промене физичког стања:

Уобичајена комбинација графика
Ако загревамо или хладимо смешу, тачка топљења и тачка кључања неће имати утврђене и константне вредности, односно неће се формирати два нивоа посматрана на графиконима горе.
Промене у физичким стањима ће се догодити у опсезима температуре, уместо у фиксној количини. Тачка топљења, на пример, започиње на датој температури, а завршава на другој, а исто ће се догодити и са тачком кључања, као што је приказано на доњем графикону:

Два изузетка су еутектичке и азеотропне смеше. Погледајте шта им се дешава:
а) Еутектичка смеша
Еутектичка смеша се током фузије понаша као да је чиста супстанца, односно у овом тренутку температура остаје константна од почетка до краја промене агрегационог стања.

б) азеотропна смеша
Азеотропна смеша се понаша као чиста супстанца током кључања, односно у овом тренутку температура остаје константна од почетка до краја промене агрегационог стања.

Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Карте промена физичког стања“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm. Приступљено 28. јуна 2021.